题目内容
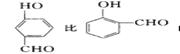
(5分)(1)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
(2)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子。甲和乙的主要物理性质比较如下:
①1 mol乙分子含有 个σ键;
②丙分子的中心原子采取 杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是
(结合具体物质解释)。
| 代号 | 物质 | 结构简式 | 水中溶解度/g (25℃) | 熔点/℃ | 沸点/℃ |
| A | 对—硝基苯酚 | 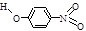 | 1.7 | 114 | 295 |
| B | 邻—硝基苯酚 | 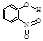 | 0.2 | 45 | 100 |
| | 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| 甲 | 187 | 202 | 2.6 |
| 乙 | 272 | 423 | 以任意比互溶 |
②丙分子的中心原子采取 杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是
(结合具体物质解释)。
(1)A(1分)
(2)① 3NA(1分) ,②sp3 (1分)
③甲是H2S,而乙是H2O2,H2O2分子间还存在分子间氢键 (2分) 。
(2)① 3NA(1分) ,②sp3 (1分)
③甲是H2S,而乙是H2O2,H2O2分子间还存在分子间氢键 (2分) 。
试题分析:(1)根据表中数据,对—硝基苯酚比邻—硝基苯酚的熔沸点高很多,说明分子间形成了氢键。
(2)甲、乙、丙所含原子的数目依次为3、4、8,都含有18个电子,则分别是H2S、H2O2、CH3CH3,①1 mol乙分子含有3molσ键,即个数是3NA;②CH3CH3形成四个共价键,中心原子采取sp3杂化轨道;③甲是H2S,而乙是H2O2,H2O2分子间还存在分子间氢键。
点评:通过18电子能熟练推导分子是本题的前提要求,平时学习中要熟记18电子的几种物质。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目


 沸点 。(填高或低)
沸点 。(填高或低)