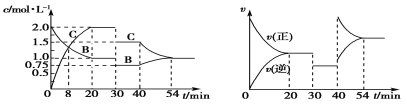
题目内容
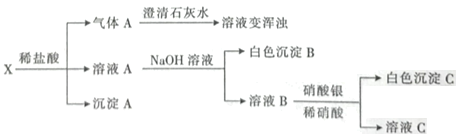
【题目】煤的气化和液化是目前实现煤综合利用的主要途径之一。以粗煤为原料合成甲醇的流程如下:

(1)煤燃烧产生的大气污染物中,能形成酸雨的有___(填字母)。
a.SO2 b.NOx
(2)过程Ⅱ中的主要反应为:C+H2O=CO+H2,反应类型是___。
(3)过程Ⅲ中反应的化学方程式是___。
(4)将煤加工处理的意义是___。
【答案】ab 置换反应 ![]() 将煤加工处理可以把煤转化成清洁能源(如氢气),减少污染物的排放,同时还可用水煤气来制备一些化工原料(如甲醇)
将煤加工处理可以把煤转化成清洁能源(如氢气),减少污染物的排放,同时还可用水煤气来制备一些化工原料(如甲醇)
【解析】
(1)酸雨分为硫酸型酸雨和硝酸型酸雨;
(2)一种单质和一种化合物反应生成另一种单质和另一种化合物的反应为置换反应;
(3)III是用CO和H2反应生产甲醇的反应;
(4)煤加工处理后变为清洁能源,产生的污染变少,能量的利用率变高。
(1)大气中的氮氧化物、硫氧化物可以和水、氧气反应得到硝酸、硫酸,形成酸雨,因此a、b均能形成酸雨;
(2)根据反应方程式不难看出这是一个置换反应,与常见的金属置换反应不同,这是一个非金属的置换反应,当然,这个反应也是一个氧化还原反应;
(3)过程III即一氧化碳和氢气在一定条件下得到甲醇的反应,根据原子数不难配平:![]() ;
;
(4)将煤加工处理可以把煤转化成清洁能源(如氢气),减少污染物的排放,同时还可用水煤气来制备一些化工原料(如甲醇)等。

【题目】化学学习小组进行如下实验。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20molL-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010molL-1KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①、②是探究__________对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__________;乙是实验需要测量的物理量,则表格中“乙”应填写__________。
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取1.260 g纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05 000 mol·L-1的KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式_____________________。
(3)某学生的滴定方式(夹持部分略去)如图,最合理的是___________(选填 a、b)。

(4)由图可知消耗KMnO4溶液体积为________________mL。

(5)滴定过程中眼睛应注视______。
(6)通过上述数据,求得x=_______。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果____________(偏大、偏小或没有影响) 。
【题目】下列“实验结论”与“实验操作及现象”不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 把一小块钠放入水中,立刻熔成小球 | 该反应是放热反应 |
B | 向某溶液中加入AgNO3溶液,产生白色沉淀 | 该溶液中一定含有Cl- |
C | 向NaHCO3溶液中滴入酚酞溶液,溶液颜色变红 | NaHCO3溶液显碱性 |
D | 向某溶液中加入NaOH溶液,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色 | 该溶液中一定含有Fe2+ |
A.AB.BC.CD.D
【题目】硫铁矿石(主要成分FeS2)用于工业制硫酸,其排出的矿渣在一定条件下以磁性氧化铁为主。经磁选获得精矿,可直接用于高炉炼铁。已知某精矿的主要成分是磁性氧化铁( Fe3O4)和Fe2O3及杂质(杂质不含铁、硫、氧元素,且杂质不耗氧)。请回答下列问题:
(1)某硫铁矿石中(杂质不含铁、硫)含硫的质量分数是0.360,则该硫铁矿石中含铁元素的质量分数是________(答案用小数表示,保留3位小数)。
(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98.0%的硫酸1.92吨时(不考虑硫的损失),则炼铁厂(不计选矿及炼铁时铁的损耗)最多可生产含碳4.00%的生铁____吨(答案保留3位小数)。
(3)煅烧硫铁矿常用富氧空气。从沸腾炉排出的气体成分如下表。如果精矿中铁、氧的物质的量之比为n (Fe):n(O)=5:7,则富氧空气中O2和N2的体积比(最简单的整数比)为_________。
气体 | SO2 | N2 | O2 |
物质的量 | 10 | 58 | 6 |
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为________(最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | I | II | III |
加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
则该硫酸溶液的物质的量浓度为________________。
③若在上述实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(写出必要的步骤,答案保留3位小数)_______________。