题目内容
15.已知A,B,C均为短周期元素,A,C同周期,A,C的最低价离子分别为Am-和Cn-,离子半径:Am-<Cn-,B2+和Cn-具有相同的电子层结构,下列说法正确的是( )| A. | 原子序数:B>C>A | B. | 原子半径:B>A>C | ||
| C. | 对应气态氢化物的稳定性:A>C | D. | 还原性:Am->Cn- |
分析 A.短周期元素中,A、C同周期,A、C的最低价离子分别为Am-和Cn-,离子半径:Am-<Cn-,则原子序数A>C,B2+和Cn-具有相同的电子层结构,则B在C的下一周期,A、C位于第二周期,可推知B为Mg元素;
B.同周期自左而右原子半径减小、同主族自上而下原子半径增大;
C.元素非金属性越强,对应氢化物越稳定;
D.元素非金属性越强,阴离子还原性越弱.
解答 解:A.短周期元素中,A、C同周期,A、C的最低价离子分别为Am-和Cn-,离子半径:Am-<Cn-,则原子序数A>C,B2+和Cn-具有相同的电子层结构,则B在C的下一周期,A、C位于第二周期,可推知B为Mg元素,故原子序数B>A>C,故A错误;
B.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径B>C>A,故B错误;
C.同周期自左而右元素非金属性增强,元素非金属性越强,对应氢化物越稳定,故气态氢化物的稳定性:A>C,故C正确;
D.元素非金属性A>C,元素的非金属性越强,对应阴离子的还原性越弱,则还原性Am-<Cn-,故D错误,
故选C.
点评 本题考查原子结构与元素周期律的关系,侧重于元素周期律与学生的分析能力的考查,题目难度不大,本题的关键是根据原子结构特点正确推断元素在周期表中位置.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
5.下列说法正确的是( )
| A. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| B. | 将8.0gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为0.2mol/L | |
| C. | 阿伏加德罗常数个H2O分子在标准状况下的体积是22.4L | |
| D. | 在标准状况下,20mLNH3与60mLO2所含的分子个数比为1:3 |
6.下列各组物质中,互为同系物的是( )
| A. |  与 与 | B. |  与 与 | C. |  与 与 | D. |  与 与 |
3.用下列装置进行相应的实验,能达到实验目的是( )


| A. | 用图1装置制取乙酸乙酯 | |
| B. | 用图2装置制取、收集乙炔气体 | |
| C. | 用图3检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| D. | 用图4检验C2H5OH 与浓H2SO4加热至170℃制取乙烯 |
10.下列各组中两个变化所发生的反应,属于同一类型的是( )
①由乙烯制取乙烷,由乙烷制溴乙烷;
②乙烯使溴水褪色,乙炔使酸性高锰酸钾水溶液褪色;
③由乙烯制聚乙烯,由乙炔制聚乙炔;
④由乙烯制取氯乙烷,由乙炔制取氯乙烯.
①由乙烯制取乙烷,由乙烷制溴乙烷;
②乙烯使溴水褪色,乙炔使酸性高锰酸钾水溶液褪色;
③由乙烯制聚乙烯,由乙炔制聚乙炔;
④由乙烯制取氯乙烷,由乙炔制取氯乙烯.
| A. | 只有②③ | B. | 只有③④ | C. | 只有①③ | D. | 只有①④ |
9.下列有关叙述:①非金属单质N能从M的化合物中置换出非金属单质M;②M原子比N原子容易得到电子;③Na-的还原性强于Mb-;④单质熔点M>N.能说明非金属元素M比N的非金属性强的是( )
| A. | ①② | B. | ②③ | C. | ②③④ | D. | ③④ |
6.下列物质属于纯净物的是( )
| A. | 聚乙烯 | B. | 冰醋酸 | C. | 福尔马林 | D. | 碘酒 |
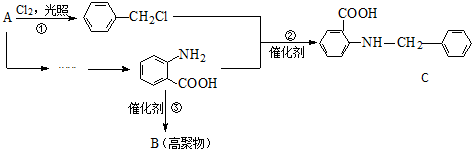
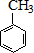 $→_{水浴加热}^{浓H_{2}SO_{4}/浓HNO_{3}}$
$→_{水浴加热}^{浓H_{2}SO_{4}/浓HNO_{3}}$
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$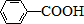
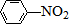 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$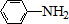 (弱碱性,易被氧化)
(弱碱性,易被氧化) .
.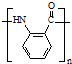 .
. 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构.
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构.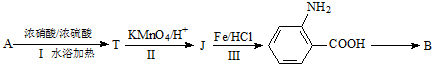
 .
. ;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.
;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.