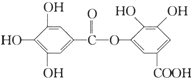
题目内容
【题目】(1)对于下列反应:2SO2+O2![]() 2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
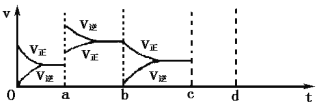
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。
2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。
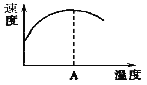
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,上图右表示酶参加的反应中温度与反应速率的关系,解释曲线变化原因 。
【答案】(1)2 mol/(L·min) 1 mol/(L·min) 2mol/L
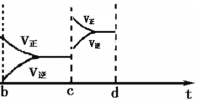
(2)升高温度;减小SO3的浓度(示意图如下)
(3)温度低时,酶具有催化作用,随温度的升高反应速率加快;较高温度时,酶因受热变性而失去催化作用,故速率反而降低。
【解析】
试题分析:(1)用SO2浓度变化来表示的化学反应速率为v=![]() =
=![]() =2mol/(Lmin),v(O2)=
=2mol/(Lmin),v(O2)=![]() v(SO2)=1mol/(Lmin),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以二氧化硫的反应速率是氧气的2倍为1mol/(Lmin),2min内二氧化硫浓度的变化量为1mol/(Lmin)×2min=2mol/L,则二氧化硫的平衡浓度=4mol/L-2mol/L=2mol/L;
v(SO2)=1mol/(Lmin),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以二氧化硫的反应速率是氧气的2倍为1mol/(Lmin),2min内二氧化硫浓度的变化量为1mol/(Lmin)×2min=2mol/L,则二氧化硫的平衡浓度=4mol/L-2mol/L=2mol/L;
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率。
(3)温度低时,酶具有催化作用,随温度的升高反应速率加快;较高温度时,酶因受热变性而失去催化作用,故速率反而降低。