题目内容
【题目】将等物质的量的A、B、C、D四种物质混合放入VL密闭容器中,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了n mol。此时反应达到平衡。
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了n mol。此时反应达到平衡。
(1)以B的浓度变化表示的该反应的速率为v (B)= 。
(2)该化学方程式中,各物质的化学计量数分别为:a b c d
(3)若只改变压强,反应速率变化但平衡状态不移动,则各物质的聚集状态分别是:A B D 。若在上述平衡混合物中再加入B物质,上述平衡
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.条件不够,无法判断
(4)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为 反应。(填“放热”或“吸热”)
【答案】(1)![]() mol·/(L·min)
mol·/(L·min)
(2)2 1 3 2
(3)气体 固体或液体(非气体) 气体 C (4) 放热
【解析】
试题分析:(1)v(B)=![]() /tmin=
/tmin=![]() mol/(L·min)。
mol/(L·min)。
(2)反应转化的各物质的物质的量之比为
n(A)∶n(B)∶n(C)∶n(D) =nmol∶![]() mol∶
mol∶![]() mol∶nmol=2∶1∶3∶2,因此a、b、c、d分别是2、1、3、2;
mol∶nmol=2∶1∶3∶2,因此a、b、c、d分别是2、1、3、2;
(3)改变压强,反应速率改变,表明A、B、D中至少有一种是气体,而平衡并不发生移动,说明左、右两边气体物质的化学计量数之和相等,因而只可能A、D是气体而B不是气体。若在上述平衡混合物中再加入B物质,B不是气态,因此上述平衡不移动,答案选C;
(4)升高温度,平衡向逆反应方向移动,则正反应为放热反应。

 阅读快车系列答案
阅读快车系列答案【题目】下列各组物质中,不能按图示(“→”表示一步完成)关系相互转化的是
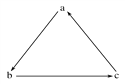
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | H2SO4 | SO2 | SO3 |
C | Si | SiO2 | H2SiO3 |
D | HNO3 | NO | NO2 |
A. A B. B C. C D. D