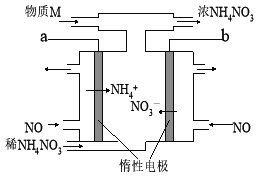
题目内容
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。请回答下列问题:
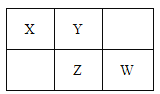
(1)元素Z位于周期表中的位置_____________。
(2)在标准状况下,用充满X元素的氢化物气体及少量空气的混合气体的烧瓶做喷泉实验,实验结束后,则烧瓶中所得溶液的物质的量浓度为____________mol/L(结果保留两位有效数字)。
(3)W、Z的最高价氧化物对应的水化物的酸性大小顺序____________(用化学式表示)。
(4)将W的单质通入含等物质的量FeBr2的溶液中,发生反应的离子方程式为
_______________________________________。
(5)Z和X形成的一种化合物相对分子质量在170~190之间,且Z的质量分数约为70%。该化合物的化学式为___________。
【答案】 第三周期 ⅥA族 0.045 HClO4>H2SO4 2Fe2+ +2Br-+ 2Cl2 =2Fe3+ + Br2 + 4Cl- S4N4
【解析】首先根据元素在周期表中的相对位置判断出元素的种类,然后结合元素周期律和单质及其化合物的性质分析解答。
由短周期元素在周期表中的相对位置,可知X、Y处于第二周期,Z、W处于第三周期,Z元素最外层电子数是其电子层数的2倍,最外层电子数为6,则Z为S元素,可推知W为Cl、Y为O、X为N,则(1)元素Z为S,在周期表中的位置是:第三周期第ⅥA族;(2)X元素的氢化物为氨气。由于氨气极易溶于水的,则充满氨气及少量空气的混合气体的烧瓶做喷泉实验,实验结束后,溶液的体积就是氨气的体积,则烧瓶中所得溶液的物质的量浓度为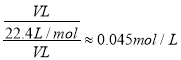 ;(3)非金属性Cl>S,故最高价氧化物对应的含氧酸的酸性:HClO4>H2SO4;(4)将氯气通入含等物质的量FeBr2的溶液中,氯气先氧化亚铁离子,再氧化溴离子,假设氯气、FeBr2均为1mol,根据电子转移守恒,则氧化1mol亚铁离子需要氯气为1mol÷2=0.5mol,剩余0.5mol氯气,根据电子转移守恒,0.5mol氯气可以氧化1mol溴离子,故反应的离子方程式为2Fe2+ +2Br-+ 2Cl2=2Fe3+ + Br2 + 4Cl- ;(5)S和N形成的一种化合物相对分子质量在170~190之间,且S的质量分数约为70%,则N元素质量分数为30%,则分子中S、N原子数目之比=70%/32:30%/14≈1:1,令分子式为(SN)n,则170<46n<190,可以确定3.7<n<4.13,故n=4,则分子式为:S4N4。
;(3)非金属性Cl>S,故最高价氧化物对应的含氧酸的酸性:HClO4>H2SO4;(4)将氯气通入含等物质的量FeBr2的溶液中,氯气先氧化亚铁离子,再氧化溴离子,假设氯气、FeBr2均为1mol,根据电子转移守恒,则氧化1mol亚铁离子需要氯气为1mol÷2=0.5mol,剩余0.5mol氯气,根据电子转移守恒,0.5mol氯气可以氧化1mol溴离子,故反应的离子方程式为2Fe2+ +2Br-+ 2Cl2=2Fe3+ + Br2 + 4Cl- ;(5)S和N形成的一种化合物相对分子质量在170~190之间,且S的质量分数约为70%,则N元素质量分数为30%,则分子中S、N原子数目之比=70%/32:30%/14≈1:1,令分子式为(SN)n,则170<46n<190,可以确定3.7<n<4.13,故n=4,则分子式为:S4N4。

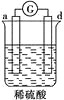
【题目】有a、b、c、d四个金属电极,有关的化学装置、部分反应现象如下:
实验装置 |
|
|
|
|
实验现象 | a极质量减小, b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. a>b>c>d B. b>c>d>a C. a>b>d>c D. d>a>b>c