题目内容
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是__________。
A.c(HA)<c(A-)
B.c(HA)一定大于0.1 mol·L-1
C.c(Na+)=c(HA)+c(A-)
D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。
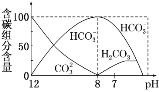
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是___________。
③已知在25 ℃时,CO32-水解反应的平衡常数Kh=2×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____________。
【答案】(1)D;
(2)①不能;②c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-);③ 10。
【解析】
试题(1)0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,反应后得到等量的HA、NaA,溶液pH大于7,则盐类水解大于酸的电离,A、水解生成HA,则c(HA)>c(A-),A错误;B、因等体积混合,则反应后c(HA)一定小于0.1mol/L,B错误;C、反应后得到等量的HA、NaA,则2c(Na+)=c(HA)+c(A-),C错误;D、由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(A-),又2c(Na+)=c(HA)+c(A-),则c(OH-)=c(H+)+![]() [c(HA)-c(A-)],D正确,故答案为:D;
[c(HA)-c(A-)],D正确,故答案为:D;
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水。
①由反应及图象可知,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,故答案为:不能;
②由图象可知,pH=7时,溶液中含碳元素的主要微粒为HCO3-、H2CO3,根据电荷守恒可知c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-),故答案为:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-);
③CO32-的水解常数Kh=![]() =2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,c(OH-)=10-4mol/L,由Kw可知,c(H+)=10-10mol/L,所以pH=10,故答案为:10
=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,c(OH-)=10-4mol/L,由Kw可知,c(H+)=10-10mol/L,所以pH=10,故答案为:10

【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
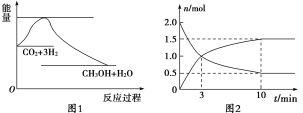
(1)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2 mol CO2和8 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) =________;
②该反应的平衡常数表达式K=________。
(2)830 ℃,反应的平衡常数K=1,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有________(填“A”“B”“C”或“D”)。
物质 | A | B | C | D |
n(CO2) | 3 | 1 | 3 | 1 |
n(H2) | 2 | 2 | 4 | 2 |
n(CH3OH) | 1 | 2 | 3 | 0.5 |
n(H2O) | 4 | 2 | 3 | 2 |
(3)25 ℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3 kJ的热量,写出该反应的热化学方程式______________________________。
【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01mol·L1 KMnO4溶液,几滴浓H2SO4 | 2mL0.3mol·L1H2C2O4 溶液 | 2 | 褪为无色 |
b | 4mL0.01mol·L1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:_____________。
(2)实验I试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为:________。
(3)瑛瑛和超超查阅资料,实验I试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验III | 实验IV | ||
实验操作 |
|
|
|
实验现象 | 6 min后固体完全溶解,溶液橙色变浅,温度不变 | 6 min后固体未溶解,溶液颜色无明显变化 | 6 min后固体未溶解,溶液颜色无明显变化 |
实验IV的目的是:_______________________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72- 浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i.MnO2与H2C2O4反应生成了Mn2+。
过程ii.__________________________________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001molMnO2加入到6mL____________中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到_______________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案是________。
(5)综合以上实验可知,草酸发生氧化反应的速率与__________________有关。
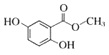
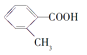
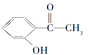
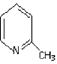
【题目】已知A——F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
化合物 | A | B | C |
结构简式 |
|
|
|
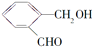
化合物 | D | E | F |
结构简式 |
|
|
|
(1)化合物A属于________类(按官能团种类分类)
(2)化合物B在一定条件下,可以与NaOH溶液发生反应,写出化合物B 与足量NaOH反应的化学方程式_____________。
(3)化合物C与D在一定条件下发生如图转化得到高分子化合物Z,部分产物已略去。

反应③中D与H2按物质的量1:1反应生成Y,则 生成Z的方程式为__________。
(4)化合物D与银氨溶液反应的化学方程式____________(有机物用结构简式表示):。
(5)写出符合下列条件的E的同分异构体的结构简式:_________。
A.苯环上只有一个取代基
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
(6)化合物F是合成“克矽平”(一种治疗矽肺病的药物)的原料之一,其合成路线如下:(说明:克矽平中氮氧键是一种特殊的共价键;反应均在一定条件下进行。)
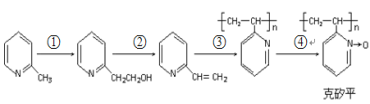
a.反应①是原子利用率100%的反应,则该反应的化学方程式为_____________;
b.上述转化关系中没有涉及的反应类型是(填代号)___________。
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应