题目内容
【题目】可逆反应:aA(g)+bB(g)![]() cC(g)+dD(g);根据图回答:
cC(g)+dD(g);根据图回答:
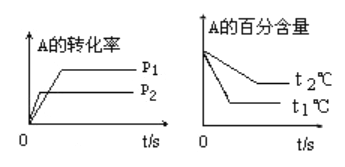
(1)压强p1比p2_____________(填“大”或“小”);(a+b)比(c+d)_____________(填“大”或“小”);温度t1比t2℃ _________(填“高”或“低”);正反应为______________热反应.
(2)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式____________________________。
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2固体和H2O(l)。已知室温下2 g SiH4自燃放出热量89.2 kJ,该反应的热化学方程式为_________________________。
(4)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4的反应焓变为_____________(用含△H1、△H2、△H3的式子表示)。
【答案】小 小 高 吸热 2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=3116.6kJ·mol-1 SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)ΔH=-1427.2kJ·mol-1 2△H1+3△H2—2△H3
【解析】
根据压强、温度对化学反应速率和化学平衡的影响,分析气体分子数的变化及反应的热效应;进行简单计算,书写热化学方程式;依据盖斯定律,求“新”反应的反应热。
(1)据题图,p1条件下反应比p2条件下达到化学平衡用的时间长,则反应较慢,压强较小(p1<p2);p1条件下化学平衡时A的转化率较大,即减压使平衡右移,则(a+b)<(c+d)。同理,t1>t2,正反应吸热。
(2)在298K时,2mol C2H6 完全燃烧放热3116.6kJ。则热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=3116.6kJ·mol-1 。
(3)由2 g SiH4自燃放热89.2 kJ,可求得1molSiH4自燃放热1427.2kJ。则热化学方程式为:
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1427.2kJ·mol-1 。
(4)将已知和所求热化学方程式编号为:
①N2(g)+O2(g)=2NO(g) △H1
②2H2(g)+O2(g)=2H2O(g) △H2
③N2(g)+3H2(g)=2NH3(g) △H3
④4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H4
据盖斯定律,有④=①×2+②×3-③×2,则△H4=2△H1+3△H2—2△H3。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案