题目内容
【题目】下列实验操作能达到目的的是( )
A.用碱石灰干燥氯气
B.用品红溶液鉴别CO2和SO2
C.用乙醇萃取碘水中的碘单质
D.用澄清石灰水检验碳酸钠溶液中是否含有碳酸氢钠
【答案】B
【解析】
A.Cl2会与碱会发生反应,因此不能使用碱石灰干燥氯气,A错误;
B.CO2不能使品红溶液褪色,而SO2具有漂白性,能够使品红溶液褪色,因此可以使用品红溶液鉴别CO2和SO2,B正确;
C.乙醇与水混溶,因此乙醇不能作萃取剂来萃取碘水中的碘单质,C错误;
D.碳酸钠、碳酸氢钠都可以与Ca(OH)2反应产生CaCO3白色沉淀,因此不能用澄清石灰水检验碳酸钠溶液中是否含有碳酸氢钠,D正确;
故合理选项是B。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】下列说法不正确的是
A.甲烷分子中的所有原子处于同一平面上
B.煤的液化、气化和干馏均属于化学变化
C.乙炔和溴的四氯化碳溶液发生加成反应而使其褪色
D.苯分子中不存在碳碳单键和碳碳双键交替出现的结构
【题目】四氯化锡用作媒染剂和有机合成上的氯化催化剂。无水四氯化锡暴露于空气中与空气中的水分反应生成白色烟雾,有强烈的刺激性气味。实验室用下列装置模拟合成四氯化锡,首先将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器B中,再向反应器中缓缓通入干燥氯气。
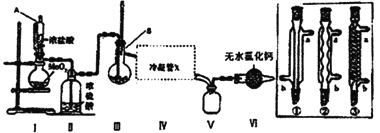
(部分夹持装置及加热仪器省略)
部分物理数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ |
Sn | 银白色固体 | 232 | 2260 |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
回答下列问题:
(1)仪器A的名称为_____________________;Ⅳ处冷凝管应选择________________________。
(2)装置I中发生反应的离子方程式为______________________________。
(3)SnCl4在空气中与水蒸气反应生成白色SnO2·xH2O固体,其反应的化学方程式为__________________________________。
(4)该装置存在的缺陷是_________________________。
(5)下列说法正确的是__________。
A.操作中应点燃Ⅲ处酒精灯再点燃Ⅰ处酒精灯
B.用锡花代替锡粒的目的主要为了提高化学反应速率
C.该实验应该在通风橱内或在通风的地方进行
D.将产品溶于盐酸,可用溴水检测,若溴水橙色褪去,说明SnCl4中含有SnCl2
E.Ⅳ处应注意在加热之前先接通冷却水,而停止加热后,仍要继续通冷却水一段时间
(6)产品中含少量SnCl2,测定SnCl4纯度的方法:取0.200g产品溶于50mL的稀盐酸中,加入淀粉溶液作指示剂,用0.0100mol/L碘酸钾标准溶液滴定至终点,消耗标准液4.00 mL,反应原理为:3SnCl2+KIO3+6HC1=3SnCl4+KI+3H2O,判断滴定终点的依据为_____________,产品的纯度为________。