题目内容
【题目】盐在化学工业中有重要的应用,请回答下列问题:
(1)用化学方程式表示配制FeCl3溶液时常加入浓盐酸的原因______________________________________________
(2)常温下,在pH=3的Al2(SO4)3溶液与pH=11的Na2S溶液中,水电离出来的c(OH﹣)之比为______,将两溶液混合后,产生白色沉淀和有臭鸡蛋味的气体,其反应的离子方程式为_________________________
(3)c(NH4+)相等的下列溶液①NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4 ⑤NH3·H2O,溶液的物质的量浓度由小到大的顺序是______________________________________________________ (用序号表示)
(4)已知t℃时①AgCl的Ksp=2×10﹣10;②在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列正确的是_______
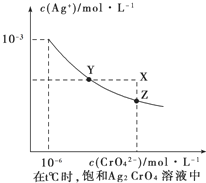
A.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
B.在t℃时Ag2CrO4的Ksp为1×10-12
C.在t℃时反应:Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
D.在t℃时以0.01mol/L的AgNO3溶液滴定20mL浓度均为0.01mol/L的KCl和K2CrO4的混合溶液,CrO42-先沉淀
【答案】 FeCl3+3H2O![]() Fe(OH)3+3HCl 1:1 2Al3++3S2-+6H2O==2Al(OH)3↓+3H2S↑ ③<②<①<④<⑤ BC
Fe(OH)3+3HCl 1:1 2Al3++3S2-+6H2O==2Al(OH)3↓+3H2S↑ ③<②<①<④<⑤ BC
【解析】试题分析:本题考查盐的水解,盐溶液中水电离的c(OH-)的计算,双水解离子方程式的书写,溶液中粒子浓度大小比较,沉淀溶解平衡曲线的分析。
(1)FeCl3属于强酸弱碱盐,在FeCl3溶液中存在水解平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,加入浓盐酸,水解平衡向逆反应方向移动,抑制FeCl3的水解,避免出现浑浊。
Fe(OH)3+3HCl,加入浓盐酸,水解平衡向逆反应方向移动,抑制FeCl3的水解,避免出现浑浊。
(2)Al2(SO4)3属于强酸弱碱盐,由于Al3+的水解使溶液呈酸性,pH=3的Al2(SO4)3溶液中c(H+)=1![]() 10-3mol/L,c(OH-)水=c(H+)水=c(H+)溶液=1
10-3mol/L,c(OH-)水=c(H+)水=c(H+)溶液=1![]() 10-3mol/L;Na2S属于强碱弱酸盐,由于S2-的水解使溶液呈碱性,pH=11的Na2S溶液中c(H+)=1
10-3mol/L;Na2S属于强碱弱酸盐,由于S2-的水解使溶液呈碱性,pH=11的Na2S溶液中c(H+)=1![]() 10-11mol/L,常温下c(OH-)=1
10-11mol/L,常温下c(OH-)=1![]() 10-3mol/L,c(OH-)水=c(OH-)溶液=1
10-3mol/L,c(OH-)水=c(OH-)溶液=1![]() 10-3mol/L;两溶液中水电离出来的c(OH-)之比为1:1。Al2(SO4)3溶液和Na2S溶液混合发生双水解反应生成Al(OH)3白色沉淀和臭鸡蛋气味的H2S气体,反应的离子方程式为2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。
10-3mol/L;两溶液中水电离出来的c(OH-)之比为1:1。Al2(SO4)3溶液和Na2S溶液混合发生双水解反应生成Al(OH)3白色沉淀和臭鸡蛋气味的H2S气体,反应的离子方程式为2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。
(3)1molNH4Cl、NH4HSO4、CH3COONH4完全电离产生1molNH4+,1mol(NH4)2SO4完全电离产生2molNH4+,NH3·H2O部分电离产生NH4+,则c(NH4+)相等的溶液中,NH3·H2O(⑤)物质的量浓度最大,(NH4)2SO4溶液(③)物质的量浓度最小;在NH4HSO4溶液中NH4HSO4电离出的H+对NH4+的水解起抑制作用,在CH3COONH4溶液中CH3COO-的水解对NH4+的水解起促进作用,则c(NH4+)相等的溶液中,物质的量浓度:c(CH3COONH4)![]() c(NH4Cl)
c(NH4Cl)![]() c(NH4HSO4;c(NH4+)相等的溶液中,物质的量浓度由小到大的顺序为③
c(NH4HSO4;c(NH4+)相等的溶液中,物质的量浓度由小到大的顺序为③![]() ②
②![]() ①
①![]() ④
④![]() ⑤。
⑤。
(4)A,在Ag2CrO4饱和溶液中存在溶解平衡:Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq),加入K2CrO4,CrO42-浓度增大,平衡逆向移动,Ag+浓度减小,A项错误;B,由图可见当c(CrO42-)=10-6mol/L时,c(Ag+)=10-3mol/L,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=(10-3)2
2Ag+(aq)+CrO42-(aq),加入K2CrO4,CrO42-浓度增大,平衡逆向移动,Ag+浓度减小,A项错误;B,由图可见当c(CrO42-)=10-6mol/L时,c(Ag+)=10-3mol/L,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=(10-3)2![]() 10-6=10-12,B项正确;C,反应Ag2CrO4(s)+2Cl-(aq)
10-6=10-12,B项正确;C,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数=
2AgCl(s)+CrO42-(aq)的平衡常数=![]() =
=![]() =
=![]() =
=![]() =2.5
=2.5![]() 107,C项正确;D,Cl-开始沉淀时c(Ag+)=
107,C项正确;D,Cl-开始沉淀时c(Ag+)=![]() =2
=2![]() 10-8mol/L,CrO42-开始沉淀时c(Ag+)=
10-8mol/L,CrO42-开始沉淀时c(Ag+)=![]() =1
=1![]() 10-5mol/L
10-5mol/L![]() 2
2![]() 10-8mol/L,Cl-先沉淀,D项错误;答案选BC。
10-8mol/L,Cl-先沉淀,D项错误;答案选BC。

 名校课堂系列答案
名校课堂系列答案
