题目内容
12.4.8g镁与200mL稀硫酸完全反应(反应前后溶液体积的变化忽略不计).求产生的气体在标准状况下的体积和所得溶液中镁离子的物质的量浓度.分析 发生反应:Mg+H2SO4=MgSO4+H2↑,根据n=$\frac{m}{M}$计算4.8gMg的物质的量,根据方程式计算氢气、硫酸、硫酸镁的物质的量,再根据V=nVm计算氢气体积,根据c=$\frac{n}{V}$计算镁离子的物质的量浓度.
解答 解:4.8g Mg的物质的量为$\frac{4.8g}{24g/mol}$=0.2mol
Mg+H2SO4 =MgSO4 +H2↑
1 1 1 1
0.2mol n(H2SO4)n(MgSO4) n(H2)
n(H2SO4)=n(MgSO4)=n(H2)=$\frac{0.2mol×1}{1}$=0.2mol
故标况下,V(H2)=0.2mol×22.4L/mol=4.48L,
溶液中c(Mg2+)=c(MgCl2)=$\frac{0.2mol}{0.2L}$=1mol/L,
答:产生的气体在标准状况下的体积为4.48L;
反应完全后,所得溶液中镁离子的物质的量浓度为1mol/L.
点评 本题考查化学方程式有关计算,比较基础,侧重考查学生简单计算能力,有利于基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列实验能达到目的是( )
| 序号 | 实验目的 | 实验操作 |
| A | 证明Ksp(AgI)<Ksp(AgCl) | 在AgNO3溶液中滴加少量NaCl溶液,产生白色沉淀,继续滴加少量KI溶液又产生黄色沉淀 |
| B | 阿司匹林的提纯,即除去混有的水杨酸聚合物等杂质 | 将阿司匹林粗品溶解在适量饱和碳酸氢钠溶液中,抽滤后在滤液中加入盐酸,再抽滤并洗涤 |
| C | 检验火柴头中含氯元素 | 往浸过火柴头的溶液中加AgNO3溶液和稀硝酸 |
| D | 加快锌与稀硫酸反应制取H2的速率 | 在稀硫酸中滴加少量Cu(NO3)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
10.用18O标记的叔丁醇[(CH3)3C-18OH]与乙酸发生酯化反应(记为反应①)、用18O标记的乙醇(C2H5-18OH)与硝酸发生酯化反应(记为反应②)后,18O都存在于水中.关于上述两个反应机理有这样两个解释:
Ⅰ、酸提供羟基、醇提供羟基上的氢原子结合成水;
Ⅱ、醇提供羟基、酸提供羟基上的氢原子结合成水.
下列叙述中正确的是( )
Ⅰ、酸提供羟基、醇提供羟基上的氢原子结合成水;
Ⅱ、醇提供羟基、酸提供羟基上的氢原子结合成水.
下列叙述中正确的是( )
| A. | ①、②两个反应的机理都是Ⅰ | B. | ①、②两个反应的机理都是Ⅱ | ||
| C. | ①的机理是Ⅰ,②的机理是Ⅱ | D. | ①的机理是Ⅱ,②的机理是Ⅰ |
7.最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述正确的是( )
| A. | 该晶体的熔沸点低、硬度小 | |
| B. | 晶体中碳原子数与C-O化学键数之比为1:2 | |
| C. | 晶体的空间最小环共有6个原子构成 | |
| D. | 该晶体中碳原子和氧原子的个数比为1:2 |
7.关于盐类水解,下列叙述不正确的是( )
| A. | 是中和反应的逆反应 | |
| B. | 水的电离平衡被破坏 | |
| C. | 盐类水解破坏盐的电离平衡 | |
| D. | 配制硫酸铜溶液时,加入适量的硫酸,是为了抑制硫酸铜的水解 |
4.一定温度下,向一个容积为2L的真空密闭容器中(事先装入催化剂)通入1mol N2和3mol H2,发生下列反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3.3min后测得密闭容器内的压强是起始时的0.9倍,在此时间内v(H2)是( )
| A. | 0.2 mol/(L•min) | B. | 0.6 mol/(L•min) | C. | 0.1 mol/(L•min) | D. | 0.3 mol/(L•min) |
1.下列说法正确的是( )
| A. | 充电电池可无限制地反复充放电 | |
| B. | 电能是一次能源 | |
| C. | 通过化学反应可实现能量间的相互转化 | |
| D. | 燃料电池的能量转化率可达100% |
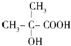
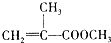 )是有机玻璃的单体,其分子在核磁共振氢谱图中能显示3个不同的峰.下列物质属于甲基丙烯酸甲酯同分异构体的是①④(填选项序号)
)是有机玻璃的单体,其分子在核磁共振氢谱图中能显示3个不同的峰.下列物质属于甲基丙烯酸甲酯同分异构体的是①④(填选项序号)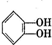 ④
④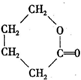
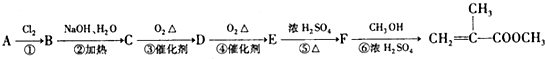
 .
.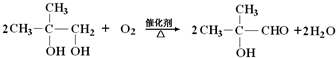 ;
; .
.