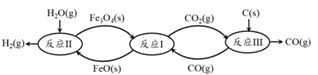
题目内容
【题目】高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+ 550 kJ/mol,它由两步反应组成:
i.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ/molii.SO3(g)分解。
(1)SO3(g)分解的热化学方程式为________________。
(2)工业上常用SO2制备Na2S2O3,向0.1 mol/L的Na2S2O3溶液中滴加稀硫酸的离子方程式为_________。
(3)反应ii的△S_______________0(填 “>”、 “<”、 “=”)。
(4)对反应ii,可用V2O5 作催化剂。已知:SO2+V2O5![]() SO3+V2O4 K1、1/2O2+V2O4
SO3+V2O4 K1、1/2O2+V2O4![]() V2O5 K2, 则在相同温度下,2SO3(g)
V2O5 K2, 则在相同温度下,2SO3(g)![]() 2SO2(g)+O2(g)的平衡常数 K=______________(用K1、K2表示)。
2SO2(g)+O2(g)的平衡常数 K=______________(用K1、K2表示)。
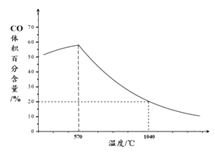
(5) L(L1、L2),X可分别代表压强或温度,右图表示L一定时,反应ii中SO3(g)的平衡转化率随X的变化关系。

①X代表的物理量是_________________;
②比较L1、L2的大小_________________。
(6)维持体系总压p恒定,在T oC时,物质的量为9 mol、体积为2L的SO3(g)发生反应:2SO3(g)![]() 2SO2(g)+O2(g), 已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=_____________(用最简分数表示)。
2SO2(g)+O2(g), 已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=_____________(用最简分数表示)。
【答案】
(1)2SO3(g)=2SO2(g)+O2(g)△H=+196kJ/mol;
(2)S2O32-+2H+=S↓+SO2↑+H2O;
(3)>;(4)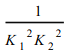 ;
;
(5)①压强②L2>L1(6)1/18mol/L
【解析】
试题分析:(1)由题意知,
①2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+550kJmol-1
②H2SO4(l)═SO3(g)+H2O(g)△H=+177kJmol-1
将方程式①-2②得2SO3(g)![]() 2SO2(g)+O2(g)
2SO2(g)+O2(g)
△H=(+550kJmol-1)-2(+177kJmol-1)=+196kJmol-1,
故答案为:2SO3(g)2SO2(g)+O2(g)△H=+196kJmol-1;
(2)Na2S2O3溶液中滴加稀硫酸发生氧化还原反应生成二氧化硫和单质硫,该反应的的离子方程式为:S2O32-+ 2H+ = S↓ +SO2↑ + H2O。
(3)2SO3(g)2SO2(g)+O2(g)是气体分子数最多的反应,所以△S>0。
(4)已知:①SO2+V2O5 ![]() SO3+V2O4 K1、②1/2O2+V2O4
SO3+V2O4 K1、②1/2O2+V2O4![]() V2O5 K2,-2×(①+②)可得反应2SO3(g)
V2O5 K2,-2×(①+②)可得反应2SO3(g) ![]() 2SO2(g)+O2(g),则在相同温度下,2SO3(g)
2SO2(g)+O2(g),则在相同温度下,2SO3(g)![]() 2SO2(g)+O2(g)的平衡常数为
2SO2(g)+O2(g)的平衡常数为![]() ;
;
(5)①由图可知,X越大,转化率越低,升高温度转化率增大,则X表示压强;
②由2SO3(g)2SO2(g)+O2(g) △H>0,温度高,转化率大,图中等压强时L2对应的转化率大,则L1<L2。
(6)维持体系总压p恒定,在T oC时,物质的量为9 mol、体积为2L的SO3(g)发生反应:2SO3(g)![]() 2SO2(g)+O2(g), 当SO3的平衡转化率25%时,参加反应的SO3的物质的量为9/4mol,生成SO29/4mol,生成O29/8mol,达到平衡时气体物质的量总和为(9-9/4)mol+9/4mol+9/8mol=81/8mol。由于总压强恒定,所以,达到平衡后气体体积为9/4L,则平衡时各物质的浓度为c(SO3)=3mol/L、c(SO2)=1mol/L、c(O2)=0.5mol/L,则在该温度下反应的平衡常数K=[c2(SO2)c(O2)]/c2(SO3)=1/18mol/L。
2SO2(g)+O2(g), 当SO3的平衡转化率25%时,参加反应的SO3的物质的量为9/4mol,生成SO29/4mol,生成O29/8mol,达到平衡时气体物质的量总和为(9-9/4)mol+9/4mol+9/8mol=81/8mol。由于总压强恒定,所以,达到平衡后气体体积为9/4L,则平衡时各物质的浓度为c(SO3)=3mol/L、c(SO2)=1mol/L、c(O2)=0.5mol/L,则在该温度下反应的平衡常数K=[c2(SO2)c(O2)]/c2(SO3)=1/18mol/L。
故答案为:1/18mol/L。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2,在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,
(1)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显________性,用化学平衡原理解释:__________________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)+c(H-)=c(SO32-)+c(HSO3-)+c(OH-)
(2) 能证明Na2SO3溶液中存在SO32-+H2O![]() HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去