题目内容
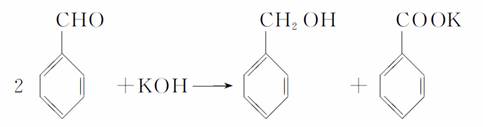
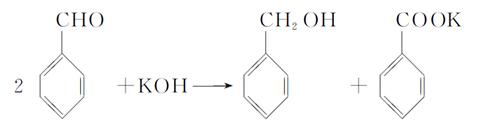
实验室中用苯甲醛制备苯甲醇和苯甲酸,已知反应原理:
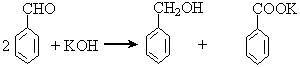
苯甲醛易被空气氧化;苯甲醇的沸点为205.3℃;苯甲酸的熔点121.7℃,沸点249℃,溶解度0.34 g(常温);乙醚的沸点34.8℃,难溶于水。
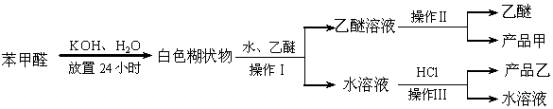
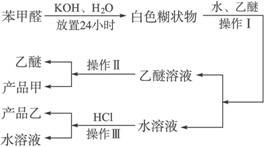
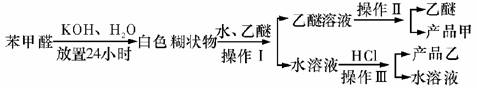
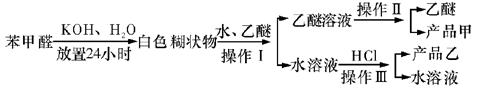
制备苯甲醇和苯甲酸的主要过程如下:
试回答:
(1)混合苯甲醛、氢氧化钾和水应选用的仪器是 (填序号)
A.带胶塞的锥形瓶B.玻璃棒和玻璃片C.烧杯D.容量瓶
(2)操作Ⅰ的名称是 ,乙醚溶液中的主要成分是 。
(3)操作Ⅱ的名称是 。
(4)操作Ⅲ的名称是 ,产品乙是 。
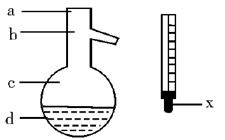
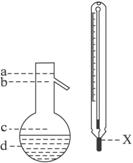
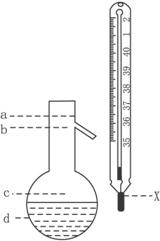
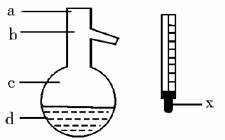
(5)在使用图示仪器的操作中,温度计水银球的上沿X的放置位置为
(填图示a、b、c、d)。该操作中,除图中两仪器外,还需使用的仪器有酒精灯、带附件的铁架台、橡胶塞、各种玻璃导管、橡胶管及 等必要仪器(错填、多填、少填均扣分)。分离产品的适宜温度是 。
解析:
(1)A (2)萃取和分液,苯甲醇 (3)分馏(或蒸馏) (4)过滤; 苯甲酸 (5)b; 水冷凝器、锥形瓶、石棉网; 34.8℃左右
|
提示:
(1)由于苯甲醛易被空气氧化,故苯甲醛制备苯甲醇和苯甲酸时,需在密封的条件下,由其反应原理可知,该反应是在碱性条件下上进行的,只能用带胶塞的锥形瓶,故答案为A。 (2)由反应原理可知:白色糊状物为苯甲醇和苯甲酸钾,将该白色糊状物与水和乙醚混合时,由于乙醚和水不混溶,而苯甲醇易溶乙醚。 (3)乙醚溶液中主要含有 (4) (5)图示仪器是在操作Ⅱ中分馏时用的,温度计水银球必位于蒸馏烧瓶的支管口处。蒸馏装置除了带温度计的蒸馏烧瓶外,还应有冷凝管及作为接收器的锥形瓶等。
|

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案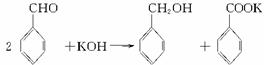
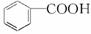
 (填序号)。
(填序号)。 。
。