题目内容
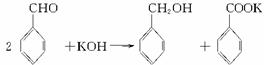
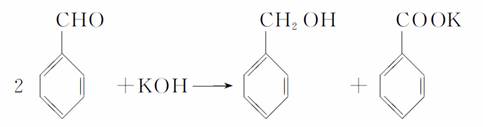
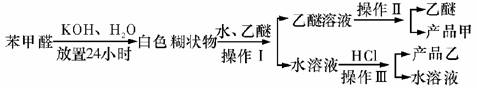
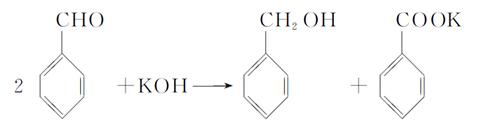
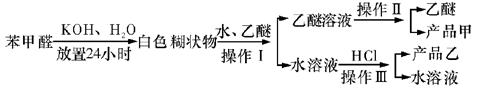
实验室中用苯甲醛制备苯甲醇和苯甲酸,已知反应原理: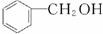
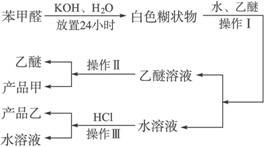
苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g(常温);乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下:
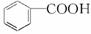
试回答。
(1)混合苯甲醛、氢氧化钾和水应选用的仪器是_________(填序号)。
A.带胶塞的锥形瓶 B.玻璃棒和玻璃片
C.烧杯 D.容量瓶
(2)操作Ⅰ的名称是_________,乙醚溶液中的主要成分是_________。
(3)操作Ⅱ的名称是_________。
(4)操作Ⅲ的名称是_________,产品乙是_________。
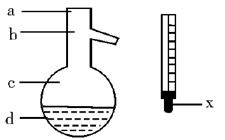
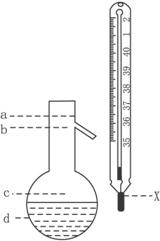
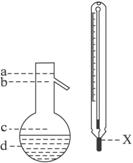
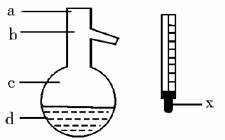
(5)在使用图示仪器的操作中,温度计水银球的上沿x的放置位置为_________ (填图所示a、b、c、d)。
该操作中,除图中两仪器外,还需使用的仪器有酒精灯、带附件的铁架台、橡皮塞、各种玻璃导管、橡胶管及_________等必要仪器。分离产品的适宜温度是_________。
解析:根据题所给信息可知苯甲醛易被空气中的氧气氧化,且由苯甲醛制取苯甲醇和苯甲酸时要放置24小时,所以混合苯甲醛、氢氧化钾和水时,应选用密闭容器——带胶塞的锥形瓶。对题目中所给苯甲酸和苯甲醇的物理性质进行对比分析,选择合理的分离方法,特别要注意进行分馏(或蒸馏)操作时所用的仪器,温度计水银球的放置位置。
答案:(1)A
(2)萃取和分液 苯甲醇(或![]() )
)
(3)分馏(或蒸馏)
(4)过滤 苯甲酸(或![]() )
)
(5)b 水冷凝器、锥形瓶、石棉网 34.8 ℃左右

练习册系列答案
相关题目
 (填序号)。
(填序号)。 。
。