题目内容
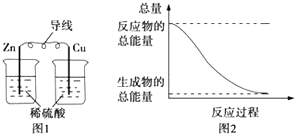
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。

已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
(1)图中E的大小对该反应的反应热________(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点___________ (填“升高”还是“降低”)。
(2)完成SO2氧化为SO3的热化学方程式______________________________________。
(3)铝元素在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制。铝及其化合物在下列场合使用时必须严格加以控制的是________(填字母)
A.用明矾净水 B.制电线电缆 C.制包糖果用的铝箔 D.制防锈油漆
(4)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强酸或强碱都会溶解,请写出氧化膜与氢氧化钠溶液反应的化学方程式:_____________________

(5)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2,其物质转化如图所示。写出其中氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式:_____________。
【答案】 无 降低 2SO2(g)+O2(g) =2SO3(g) ΔH= —198kJ·mol-1 AC Al2O3 +2NaOH=2NaAlO2+H2O CuFe2O4-x+ xH2O = CuFe2O4+ xH2↑
【解析】(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂,活化能减小,反应反应热不变;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJmol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJmol-1;
(3)铝是食品污染源之一,所以只要与人口腔接触的含有铝的物质就需要加以控制;A.用明矾净水,与人口腔接触,需要控制,故A正确;B.制电线、电缆,与人口腔不接触,所以不需要控制,故B错误;C.制包糖果用的铝箔,与人口腔接触,需要控制,故C正确;D.制防锈油漆,与人口腔不接触,所以不需要控制,故D错误;故答案为AC;
(4)氧化铝为两性氧化物,可与酸、碱反应生成盐和水,其与氢氧化钠溶液反应的化学方程式为Al2O3+2NaOH=NaAlO2+H2O;
(5)CuFe2O4-x与水反应生成氢气和CuFe2O4,反应方程式为CuFe2O4-x+xH2O═CuFe2O4+xH2↑。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案