题目内容
【题目】Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.
Ⅰ:下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)装置B中饱和食盐水的作用是____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入__________。
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
II:制备高铁酸钾的方法有干法和湿法。
(3)干法制备高铁酸钾的主要反应为:
2FeSO4+ 6Na2O2= 2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑
①该反应中的还原剂是_______,每生成lmolNa2FeO4转移____个电子。
②简要说明K2FeO4作为水处理剂时所起的作用________________________________,
(4)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:____________________________________。
【答案】 除去Cl2中的HCl 锥形瓶中液面下降,长颈漏斗中液面上升 D Na2O2和FeSO4 5 NA 高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降 2Fe(OH)3+ 3ClO-+ 4OH-= 2FeO42-+ 3Cl-+ 5H2O
【解析】Ⅰ.(1)氯化氢极易溶于氯化钠溶液,但氯气不易溶于氯化钠溶液;若发生堵塞,气体压强增大易导致液面上升;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条,氯气和水反应生成次氯酸具有漂白性;碱石灰不能干燥氯气、U形管中干燥剂应是固体;II:(3)①2FeSO4+6Na2O2═2NaFeO4+2Na2O+2Na2SO4+O2↑中Fe元素的化合价升高,O元素的化合价既有降低又有升高,由化合价的变化计算转移的电子数;
②K2FeO4中Fe元素的化合价为+6价,具有强氧化性,且还原产物铁离子能水解;
(4)①湿法制备高铁酸钾(K2FeO4),可知Fe(OH)3被氧化为FeO42-,铁元素化合价升高,则氯元素化合价降低,一定是C1O-被还原为C1-。
解析:Ⅰ.(1)反应过程中氯化氢和水蒸气是氯气中 的杂质,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,锥形瓶中液面下降,长颈漏斗中液面上升;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中氯气和水反应生成次氯酸具有漂白性,Ⅱ中是干燥剂,III中放湿润的有色布条不能验证氯气的漂白性,所以C中应是干燥的有色布条,故ab错误;U形管中干燥剂应是固体,故c错误,故选d;
Ⅱ.(1)①2FeSO4+6Na2O2═2NaFeO4+2Na2O+2Na2SO4+O2 ↑,FeSO4中Fe元素、Na2O2中O元素的化合价升高及升高又降低,则还原剂为Na2O2、FeSO4,由降低O元素可知每生成1mo1Na2FeO4转移的电子数为1mol×5×(2-1)=5mol,则转移电子数为5NA;
②K2FeO4中Fe元素的化合价为+6价,具有强氧化性,且还原产物铁离子能水解氢氧化铁胶体,胶体具有吸附性能吸附除去水中的悬浮杂质;
(2)可知Fe(OH)3被氧化为FeO42-,铁元素化合价升高,则氯元素化合价降低,一定是C1O-被还原为C1-,该离子反应为2Fe(OH)3+3C1O-+4OH-═2FeO42-+3C1-+5H2O。

【题目】某兴趣小组的同学发现,将CuSO4溶液与K2CO3溶液混合会产生蓝绿色沉淀,它们对沉淀的组成和兴趣,决定采用实验大方法进行探究。
(1)【提出猜想】
猜想1:所得沉淀为Cu(OH)2;
猜想2:所得沉淀为______________________;(填化学式)
猜想3:所得沉淀为碱式碳酸铜[化学式可表示为mCu(OH)2·nCuCO3]。
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画)进行定性实验;
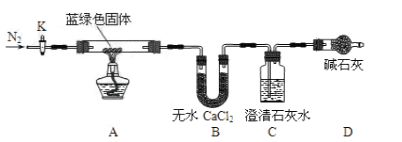
(2)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设________成立。
(3)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是_______(填代号)。
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(4)乙同学验证假设3成立的实验现象是______________。
【定量探究】
(5)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在常温时的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是__________(填代号)。
溶解度(S)/p | 溶度积(Ksp) | 摩尔质量(M)/g·mol | |||
Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
A.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为27.1g,实验结束后,装置B的质量增加2.7g,C中产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为__________;A中发生反应的化学方程式为_____。