题目内容
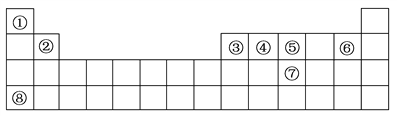
【题目】下表列出了A~R九种元素在周期表的位置:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | R | F | |||||
3 | A | C | D | H | I | G | ||
4 | B |
(1)写出R单质分子的电子式____________。
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是_________________ (填化学式)
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为 __________________(用元素的离子符号表示)
(4)写出A的单质与水反应的化学方程式____________________
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g。X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应。
X的元符号是_______________,它位于元素周期表中______________________
【答案】 ![]() NaOH K+>Na+>Mg2+ 2Na + 2H2O =2NaOH +H2 ↑ Al 第3周期ⅢA族
NaOH K+>Na+>Mg2+ 2Na + 2H2O =2NaOH +H2 ↑ Al 第3周期ⅢA族
【解析】本题考查元素周期表和元素周期律的应用,(1)根据元素在周期表中位置,R为N,其单质为N2,两个氮原子共用三个电子对,电子式为:![]() ;(2)三种元素分别是Na、Mg、Al,金属性越强,其最高价氧化物的水化物碱性越强,同周期从左向右金属性减弱,因此最高价氧化物的水化物碱性大小是NaOH>Mg(OH)2>Al(OH)3,因此碱性最强的是NaOH;(3)简单离子是Na+、K+、Mg2+,电子层数越多,半径越大,K+有三个电子层,另外两个有两个电子层,因此K+半径最大,Na+、Mg2+核外电子层数相同,离子半径随着原子序数的增大而减小,因此离子半径大小顺序是K+>Na+>Mg2+;(4)A为Na,与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑;(5)X的氢氧化物表现两性,因此X为Al,位于第三周期第IIIA族。
;(2)三种元素分别是Na、Mg、Al,金属性越强,其最高价氧化物的水化物碱性越强,同周期从左向右金属性减弱,因此最高价氧化物的水化物碱性大小是NaOH>Mg(OH)2>Al(OH)3,因此碱性最强的是NaOH;(3)简单离子是Na+、K+、Mg2+,电子层数越多,半径越大,K+有三个电子层,另外两个有两个电子层,因此K+半径最大,Na+、Mg2+核外电子层数相同,离子半径随着原子序数的增大而减小,因此离子半径大小顺序是K+>Na+>Mg2+;(4)A为Na,与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑;(5)X的氢氧化物表现两性,因此X为Al,位于第三周期第IIIA族。

【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D