题目内容
10.邻甲基苯甲酸(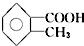 )有多种同分异构体,其中属于酯类,且分子结构中含有甲基和苯环的异构体有( )
)有多种同分异构体,其中属于酯类,且分子结构中含有甲基和苯环的异构体有( )| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
分析 据有机物属于酯类,且分子结构中有苯环,则应含有-COO-官能团,则取代基分别为-CH3和-OOCH或-OOCCH3或-COOCH3,有2个取代基时,有邻、间、对三不同结构.
解答 解:由题目要求可知该有机物的同分异构体中应具有CH3-C6H4-OOCH(-C6H4-为苯环)的结构,应有邻、间、对三种同分异构体或C6H5-OOCCH3或C6H5-COOCH3共5种,
故选B.
点评 本题考查限制条件下同分异构体的书写,掌握有机物的官能团和结构为解答该题的关键,难度中等.

练习册系列答案
相关题目
20.按碳骨架分类,下列说法正确的是( )
| A. | 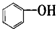 属于醇类化合物 属于醇类化合物 | B. | 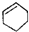 属于芳香族化合物 属于芳香族化合物 | ||
| C. | CH3CH(CH3)2属于链状化合物 | D. | 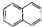 属于脂环化合物 属于脂环化合物 |
1.苹果酸的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
5. 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
(一)用铁屑与硫酸反应制备FeSO4
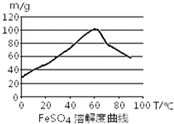
已知4Fe2++O2+4H+=4Fe3++2H2O.FeSO4在水中的溶解度见图.
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,分离出液体的方法通常不用过滤,使用的操作是倾析法(填写操作名称).
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液.温度宜控制在60℃左右;加热的同时需适当补充水,原因是防止硫酸亚铁晶体析出.反应中应保持n(Fe)/n(H2SO4)>1(填“<”、“>”或“=”).
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在.如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是防止硫酸亚铁水解.
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:
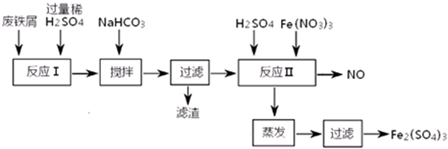
(4)加NaHCO3时,混合液pH值应控制在4.4-7.5之间.
(5)反应Ⅱ中反应的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有极其广泛的应用.(一)用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+=4Fe3++2H2O.FeSO4在水中的溶解度见图.
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,分离出液体的方法通常不用过滤,使用的操作是倾析法(填写操作名称).
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液.温度宜控制在60℃左右;加热的同时需适当补充水,原因是防止硫酸亚铁晶体析出.反应中应保持n(Fe)/n(H2SO4)>1(填“<”、“>”或“=”).
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在.如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是防止硫酸亚铁水解.
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 4.4 |
(5)反应Ⅱ中反应的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
15. 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | SO3 | H2SO4 | S |
| A. | A | B. | B | C. | C | D. | D |
2. 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )
 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述 中正确的是( )| A. | 每生成2molAB分子吸收b kJ热量 | |
| B. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 1molA-A键和1molB-B键的总键能高于2molA-B键的总键能 |
19.最近,复旦大学出现了校园铊投毒案,犯罪嫌疑人日前已被批捕.此前,清华大学也出现过类似的案例.铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是( )
| A. | 铊是易导电的银白色金属 | B. | 能生成+3价离子化合物 | ||
| C. | Tl(OH)3是两性氢氧化物 | D. | Tl3+的氧化能力比Al3+弱 |
20.下列各组物质,按化合物、单质、混合物的顺序排列的是( )
| A. | 干冰、铁、氯化氢 | B. | 生石灰、白磷、纯碱 | ||
| C. | 烧碱、液态氧、碘酒 | D. | 空气、氮气、胆矾(CuSO4•5H2O) |

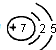 .
.
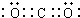 元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是
元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是 .
.