题目内容
【题目】已知25℃时,RSO4(s)+CO32-(aq)![]() RCO3(s)+SO42-(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是
RCO3(s)+SO42-(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是
A. 向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RSO4沉淀
B. 将浓度均为6×10-6mol/L的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C. 25℃时,RSO4的Ksp约为4.9×10-5
D. 相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
【答案】C
【解析】RSO4(s)+CO32-(aq)![]() RCO3(s)+SO42-(aq)的平衡常数K=
RCO3(s)+SO42-(aq)的平衡常数K=![]() =
=![]() =
=![]() =1.75
=1.75![]() 104,Ksp(RSO4)=1.75
104,Ksp(RSO4)=1.75![]() 104
104![]() Ksp(RCO3)=1.75
Ksp(RCO3)=1.75![]() 104
104![]() 2.80
2.80![]() 10-9=4.9
10-9=4.9![]() 10-5。A项,RSO4、RCO3属于同种类型且Ksp(RSO4)
10-5。A项,RSO4、RCO3属于同种类型且Ksp(RSO4)![]() Ksp(RCO3),向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RCO3沉淀,A项错误;B项,将浓度均为6
Ksp(RCO3),向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RCO3沉淀,A项错误;B项,将浓度均为6![]() 10-6mol/LRCl2、Na2CO3溶液等体积混合后,c(R2+)=3
10-6mol/LRCl2、Na2CO3溶液等体积混合后,c(R2+)=3![]() 10-6mol/L、c(CO32-)=3
10-6mol/L、c(CO32-)=3![]() 10-6mol/L,此时的离子积Qc=c(R2+)·c(CO32-)=3
10-6mol/L,此时的离子积Qc=c(R2+)·c(CO32-)=3![]() 10-6
10-6![]() 3
3![]() 10-6=9
10-6=9![]() 10-12
10-12![]() Ksp(RCO3),不会产生RCO3沉淀,B项错误;C项,根据上述计算,Ksp(RSO4)=4.9
Ksp(RCO3),不会产生RCO3沉淀,B项错误;C项,根据上述计算,Ksp(RSO4)=4.9![]() 10-5,C项正确;D项,Ksp只与温度有关,与浓度无关,相同温度下RCO3在水中的Ksp与在Na2CO3溶液中的Ksp相等,D项错误;答案选C。
10-5,C项正确;D项,Ksp只与温度有关,与浓度无关,相同温度下RCO3在水中的Ksp与在Na2CO3溶液中的Ksp相等,D项错误;答案选C。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】因瓦合金是铁和镍的合金,由于其膨胀系数极小,又称不变合金,适合做测量元件。回答下列问题:
(1)基态镍原子的价电子轨道表达式为_______;铁的基态原子核外未成对电子数为_______个。
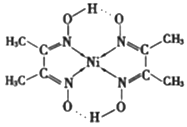
(2)在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如下图所示,该结构中碳原子的杂化方式为_______;已知丁二酮肟分子结构中C-C键与N-O键的键长和键能数据如下表所示,请从原子结构角度解释N-O键的键能小于C-C键:_______。
化学键 | 键长 (10-12m) | 键能 (kJ/mol) |
C-C | 154 | 332 |
N-O | 146 | 230 |
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、N(CO)4。1个Fe(CO)5分子中含有σ键数目为_______;已知Ni(CO)4分子为正四面体构型,下列溶剂能够溶解Ni(CO)4的是_______(填写字母)。
A.四氯化碳 B.苯 C.水 D.液氨
(4)镍晶胞为面心立方,其中镍原子的配位数为_______。氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是_______。
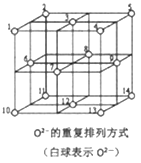
(5)Fe3O4晶体中,O2-的重复排列方式如右图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_______。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_______cm(写出计算表达式即可)。