题目内容
甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中不正确的是( )
| A、甲醇分子内C原子的杂化方式为sp3杂化 |
| B、甲醇分子内的O-C-H键角大于甲醛分子内的O-C-H键角 |
| C、甲醛分子内C原子上无孤对电子 |
| D、甲醛分子两个C-H键夹角小于120° |
考点:原子轨道杂化方式及杂化类型判断,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=配原子个数+孤电子对个数.
解答:
解:A、甲醇分子内C原子价层电子对个数=0+4=4,所以C原子的杂化方式为sp3杂化,故A正确;
B、甲醇分子内C原子的杂化方式为sp3杂化,所以O-C-H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2杂化,O-C-H键角约为120°,所以甲醇分子内的O-C-H键角小于甲醛分子内的O-C-H键角,故B错误;
C、醛分子内C原子上无孤对电子,故C正确;
D、甲醛中C是sp2杂化,C-H与C-H键夹角理论上是120度,但由于有羰基氧的孤对电子的排斥,实际键角应该略小于120度,故D正确;
故选B.
B、甲醇分子内C原子的杂化方式为sp3杂化,所以O-C-H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2杂化,O-C-H键角约为120°,所以甲醇分子内的O-C-H键角小于甲醛分子内的O-C-H键角,故B错误;
C、醛分子内C原子上无孤对电子,故C正确;
D、甲醛中C是sp2杂化,C-H与C-H键夹角理论上是120度,但由于有羰基氧的孤对电子的排斥,实际键角应该略小于120度,故D正确;
故选B.
点评:本题考查了杂化方式的判断,根据价层电子对互斥理论来分析解答即可,难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
在下列溶液中,各组离子一定能够大量共存的是( )
| A、使pH试纸呈红色的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B、由水电离的c(H+)=1×10-14mol?L-1的溶液中:NH4+、K+、Cl-、CO32- |
| C、使酚酞变红的溶液中:Na+、C6H5O-、CH3COO-、CO32- |
| D、能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、I-、SO32- |
下列叙述中不正确的是( )
| A、氯化钠的晶体结构为非等径圆球密堆积 |
| B、晶体尽量采取紧密堆积方式以使其变得比较稳定 |
| C、因为共价键有饱和性和方向性,所以原子晶体不遵循“紧密堆积”原则 |
| D、金属铜和镁均以ABAB方式密堆积 |
下列离子方程式或化学方程式书写正确的是( )
| A、碘化亚铁溶液中通入少量的氯气:2Fe2++Cl2═2Fe3++2Cl- | ||||
B、硅石和碳高温条件下反应制备粗硅:SiO2+C
| ||||
C、用惰性电极电解氯化镁溶液:2H2O+2Cl-
| ||||
| D、等物质的量的氢氧化钡和明矾反应:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
下列有关化学用语表示正确的是( )
| A、HCN的结构式:H-C≡N |
B、硝基苯的结构简式: |
C、2-戊醇的结构简式: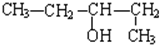 |
D、甲醛的电子式: |
对于化合物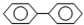 ,下列叙述中正确的是( )
,下列叙述中正确的是( )
 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A、其化学式为C12H12 |
| B、分子中所有原子有可能处于同一平面 |
| C、该化合物分子中所有原子不可能处于同一平面 |
| D、分子中所有原子一定处于同一平面 |
如图为铜锌原电池装置,下列叙述错误的是( )
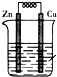

| A、Cu 片上有气泡产生 |
| B、电子由锌片通过导线流向铜片 |
| C、Zn片上发生氧化反应 |
| D、Cu片上发生氧化反应 |
近年来科学家们发现由100个碳原子构成具有完美对称性的C100分子,最内部是由20个碳原子构成的正12面体,外层的60个碳原子形成12个独立的正五边形,处于中间层次的20个碳原子将内外层碳原子连接在一起,当C100与足量氢气完全反应时,每个碳原子形成四个共价单键,其产物的分子式应为( )
| A、C100H100 |
| B、C100H80 |
| C、C100H60 |
| D、C100H40 |