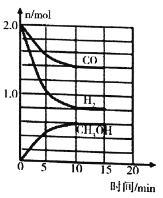
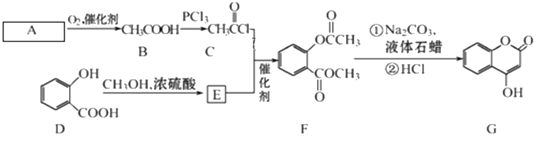
题目内容
【题目】乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的75%以上,在国民经济中占有重要的地位。有如下两个实验都能用来制备乙烯请根据要求回答问题。
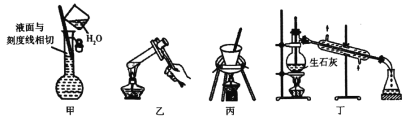
Ⅰ.已知使用活性较低的林德拉催化剂[Pd/(PdO、CaCO3)],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化成烷烃。现有一课外活动兴趣小组拟由乙炔制得乙烯,并测定乙炔氢化的转化率。若用含0.02mol CaC2的电石和1.600g含杂质18.75 %的锌粒(杂质不与酸反应)分别与足量的X和稀硫酸反应,当反应完全后,测得G中收集到的水VmL(收集到的气体已经转化为标准状况下的体积)。
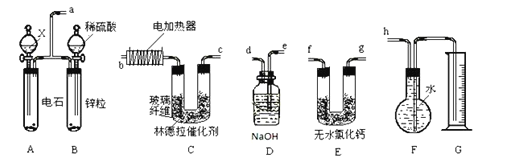
(1)试剂X为:_____。
(2)写出A中所发生反应的化学方程式(有机物写结构简式):_____。
(3)所用装置的连接顺序是_____(填各接口的字母)。
(4)若V=672mL(导管内气体体积忽略不计),则乙炔氢化的转化率为_____。
Ⅱ.实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成 SO2、CO2、水蒸气等无机物。某研究性学习小组用下图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型。
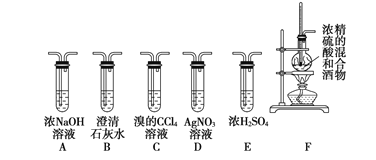
(1)为实现上述实验目的,装置的连接顺序为 F→_____→_____→_____→_____→D。(各装置限用一次),B装置的作用是_____。
(2)当C中观察到_____时,表明单质溴能与乙烯反应;若D中_______,表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是_____反应,则D装置中溶液的作用_____。
【答案】饱和食盐水 CaC2+2H2O→HC≡CH↑+Ca(OH)2 a、e、d、f、g、b、c、h(f、g可调换) 50% A B E C 检验SO2、CO2是否除尽; 溴水褪色 出现浅黄色沉淀 加成 验证乙烯与溴发生的反应类型
【解析】
Ⅰ由乙炔氢化制得乙烯,并测定乙炔氢化的转化率,由实验装置可知,X为饱和食盐水,A中制备乙炔,B中制备氢气,D中NaClO可除去硫化氢等杂质,E中干燥气体,在C中乙炔与氢气发生加成反应,最后FG排水法测定气体的体积,以此来解答;
Ⅱ实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物。为得到纯净的乙烯,应用NaOH溶液除去SO2、CO2,(并用石灰水检验是否除尽),然后用浓硫酸干燥;乙烯与单质溴之间可能发生加成反应,也可能发生取代反应,若是取代反应,则会有HBr生成,HBr与AgNO3溶液反应会产生浅黄色沉淀,据此分析解答。
Ⅰ(1)根据分析,装置A用电石和水反应来制备乙炔,为减慢A中的反应速率,X应选用饱和食盐水;
(2)根据(1)中分析,装置A用电石和水反应来制备乙炔,A 中所发生反应的化学方程式CaC2+2H2O→HC≡CH↑+Ca(OH)2;
(3)由上述分析可知,装置顺序为A→B→D→E→C→F→G,连接顺序是a、e、d、f、g、b、c、h(f、g可调换);
(4)根据反应CaC2+2H2O→HC≡CH↑+Ca(OH)2,0.020molCaC2的电石与水反应生成0.020molHC≡CH,Zn与硫酸反应的反应方程式为Zn+H2SO4=ZnSO4+H2↑,生成氢气的物质的量与参与反应的锌的物质的量相等,为![]() =0.02mol,V=672mL,即剩余气体的物质的量为
=0.02mol,V=672mL,即剩余气体的物质的量为![]() =0.03mol,设转化的乙炔为x,由HC≡CH+H2
=0.03mol,设转化的乙炔为x,由HC≡CH+H2![]() CH2=CH2可知,(0.02x)+(0.02x)+x=0.03,解得x=0.01,则乙炔氢化的转化率为
CH2=CH2可知,(0.02x)+(0.02x)+x=0.03,解得x=0.01,则乙炔氢化的转化率为![]() ×100%=50%;
×100%=50%;
Ⅱ(1)为得到纯净的乙烯,应用NaOH溶液除去SO2、CO2,(并用石灰水检验是否除尽),然后用浓硫酸干燥;乙烯与单质溴之间可能发生加成反应,也可能发生取代反应,若是取代反应,则会有HBr生成,HBr与AgNO3溶液反应会产生浅黄色沉淀,所以装置连接顺序为:F→A→B→E→C→D;用NaOH溶液除去SO2、CO2,B中的澄清石灰石水用于检验SO2、CO2是否除尽;
(2)当C中观察到溴水褪色时,表明单质溴能与乙烯反应;若D中硝酸银溶液中出现浅黄色沉淀时,表明D中生成了溴化银沉淀,则C中发生的是取代反应;若D没有出现前面所描述的现象时,说明D溶液中无溴离子,则C中发生的是加成反应;D的作用是验证乙烯与溴发生的反应类型。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
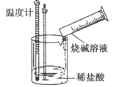
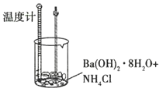
小学生10分钟应用题系列答案【题目】某实验探究小组进行如下实验,探究化学反应中的能量变化。
实验① | 实验② |
|
|
温度计读数升高 | 温度计读数降低 |
下列判断一定正确的是( )
A.实验①的反应中化学键断裂吸收的能量大于实验②
B.实验①的反应中化学键断裂吸收的能量小于实验②的反应中化学键形成放出的能量
C.实验①说明中和反应放出热量
D.实验②说明所有有氨气生成的反应均吸收热量