题目内容
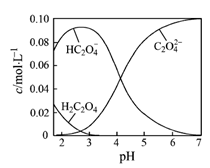
【题目】一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g) ![]() 4NO2(g)+ O2(g),反应吸热。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
4NO2(g)+ O2(g),反应吸热。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )

A.10min时,反应达到平衡
B.曲线a表示NO2的物质的量随反应时间的变化
C.0~20min内平均反应速率v(N2O5)=0.1molL-1min-1
D.达到平衡时,N2O5的转化率为60%
【答案】B
【解析】
试题分析:A、10min时,反应中的有关物质的物质的量还在变化,所以反应未达平衡状态,故A错误;B、在反应2N2O5(g)![]() 4NO2(g)+O2(g)中N2O5为反应物,NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,结合图中的数据可知曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,故B正确;C、在反应2N2O5(g)
4NO2(g)+O2(g)中N2O5为反应物,NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,结合图中的数据可知曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,故B正确;C、在反应2N2O5(g)![]() 4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,所以曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,根据v=
4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,所以曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,根据v= ![]() =
= = 0.05 mol(Lmin)-1,故C错误;D、在反应2N2O5(g)
= 0.05 mol(Lmin)-1,故C错误;D、在反应2N2O5(g)![]() 4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,所以曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,根据图象可知,达到平衡时N2O5的物质的量的变化量是2mol,所以N2O5的转化率为
4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,所以曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,根据图象可知,达到平衡时N2O5的物质的量的变化量是2mol,所以N2O5的转化率为![]() ×100%=40%,故D错误;故选B。
×100%=40%,故D错误;故选B。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:__ __。
(2)装置B中饱和食盐水的作用是_________________________________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入__ _。
A | B | C | D | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是 。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_______________________________。
(5)某同学建议将装置F中的药品改用足量的NaHSO3溶液吸收余氯,老师认为不妥,用总反应的离子方程式解释原因_____________________________________。
【题目】为提高资源的利用率,可以将富锰渣(主要成分为Mn、SiO2、Al2O3、Fe)里面的锰再提炼以利用。下图为由富锰渣制备无水氯化锰的工艺流程,回答下列问题:

(1)“浸出”前将富锰渣粉碎成细颗粒,其目的是 。
(2)滤渣I的主要成分是 (填化学式)。
(3)加入MnO2氧化时,发生反应的离子方程式为 。
(4)结合下表数据(25℃),应调节pH的范围为 ,从下表中数据计算可得Al(OH)3的溶度积,该温度下Ksp[Al(OH)3]约为 。
离子 | 开始沉淀时的pH | 完全沉淀时的pH | 沉淀开始溶解时的pH |
Al3+ | 4.0 | 5.2 | 7.8 |
Mn2+ | 8.8 | 10.4 | 14 |
(5)已知MnCl2溶液呈弱酸性,操作X为 (填字母序号)。
A.蒸发结晶 B.降温结晶 C.渗析 D.盐析
(6)MnO2的生产方法之一是以惰性电极电解MnCl2和HCl混合溶液,阳极的电极反应是 。