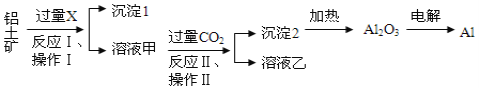
题目内容
【题目】(1)已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2 kJ ·mol-1;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0 kJ ·mol-1
Na(s) = Na(l) △H =2.6 kJ ·mol-1
请写出用液态钠与四氯化钛置换出钛的热化学方程式__________________________。
(2)已知:向一个体积恒定为2L的密闭容器中充入4mol A、1mol B,发生如下反应:4A(g)+B(s) ![]() 3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
①不能够说明该反应已达到平衡的是:________。
A.恒温下,容器内的压强不再变化
B.恒温下,容器内混合气体的密度不再变化
C.一定条件下,D的体积分数保持不变
D.一定条件下,单位时间内消耗4molA的同时生成1 mol B
②平衡后测得D的浓度为0.3mol·L-1,则从反应开始到平衡时,A的平均反应速率为________,B转化率为________。
(3)用活性炭还原法可以处理氮氧化物,有关反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
NO | N2 | CO2 | |
起始浓度/molL─1 | 0.10 | 0 | 0 |
平衡浓度/molL─1 | 0.04 | 0.03 | 0.03 |
①在t℃下,该反应的平衡常数为________(保留两位有效数字)。
②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,则该反应的
ΔH________0(填“>”、“<”或“=”),此时NO的转化率为________。
【答案】 TiCl4(l) +4Na(l) = Ti(s) +4NaCl(s) △H = -970.2kJ/mol A 0.15mol·L-1·min-1 15% 0.56 < 50%
【解析】试题分析:(1)根据盖斯定律计算液态钠与四氯化钛置换出钛的热化学方程式;(2)①根据平衡标志分析;②平衡后测得D的浓度为0.3mol·L-1,则消耗A的浓度是0.3mol·L-1;消耗A的物质的量是0.6mol、消耗B的物质的量是0.15 mol;(3)①在t℃下,该反应的平衡常数为![]() ;②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,说明升高温度平衡逆向移动;设NO的变化量为xmol,则
;②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,说明升高温度平衡逆向移动;设NO的变化量为xmol,则![]() ;
;
解析:(1) ①Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2 kJ ·mol-1;
②2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0 kJ ·mol-1
③Na(s) = Na(l) △H =2.6 kJ ·mol-1;
根据盖斯定律②![]() 2-③
2-③![]() 4-①,得液态钠与四氯化钛置换出钛的热化学方程式是TiCl4(l) +4Na(l) = Ti(s) +4NaCl(s) △H = -970.2kJ/mol;(2)①A.4A(g)+B(s)
4-①,得液态钠与四氯化钛置换出钛的热化学方程式是TiCl4(l) +4Na(l) = Ti(s) +4NaCl(s) △H = -970.2kJ/mol;(2)①A.4A(g)+B(s) ![]() 3C(s)+4D(g),反应前后气体物质的量不变,气体的压强是恒量,所以恒温下,容器内的压强不再变化不一定达到平衡状态; B.4A(g)+B(s)
3C(s)+4D(g),反应前后气体物质的量不变,气体的压强是恒量,所以恒温下,容器内的压强不再变化不一定达到平衡状态; B.4A(g)+B(s) ![]() 3C(s)+4D(g)反应前后气体质量改变,根据
3C(s)+4D(g)反应前后气体质量改变,根据![]() ,密度是变量,所以恒温下,容器内混合气体的密度不再变化一定达到平衡状态;C.反应过程中D的物质的量增加,D的体积分数是变量,所以D的体积分数保持不变一定达到平衡状态; D.一定条件下,单位时间内消耗4molA的同时生成1 mol B,可知正逆反应速率相等,一定达到平衡状态;故选A;②平衡后测得D的浓度为0.3mol·L-1,则消耗A的浓度是0.3mol·L-1;消耗A的物质的量是0.6mol、消耗B的物质的量是0.15 mol;所以从反应开始到平衡时,A的平均反应速率为
,密度是变量,所以恒温下,容器内混合气体的密度不再变化一定达到平衡状态;C.反应过程中D的物质的量增加,D的体积分数是变量,所以D的体积分数保持不变一定达到平衡状态; D.一定条件下,单位时间内消耗4molA的同时生成1 mol B,可知正逆反应速率相等,一定达到平衡状态;故选A;②平衡后测得D的浓度为0.3mol·L-1,则消耗A的浓度是0.3mol·L-1;消耗A的物质的量是0.6mol、消耗B的物质的量是0.15 mol;所以从反应开始到平衡时,A的平均反应速率为![]() mol·L-1·min-1,B转化率为
mol·L-1·min-1,B转化率为![]() ;(3)①在t℃下,该反应的平衡常数为
;(3)①在t℃下,该反应的平衡常数为![]() =
=![]() ;②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,说明升高温度平衡逆向移动,所以ΔH<0;设NO的变化量为xmol,则
;②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,说明升高温度平衡逆向移动,所以ΔH<0;设NO的变化量为xmol,则![]() ,x=0.05;此时NO的转化率为
,x=0.05;此时NO的转化率为![]() 。
。

【题目】一定条件下,下列各组物质能一步实现图中所示转化关系的是
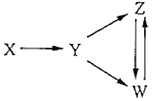
选项 | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | CH3CH2Br | CH2=CH2 | C2H5OH | CH2BrCH2Br |
A. A B. B C. C D. D