题目内容
【题目】Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出一点即可)。_________
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:

(1)甲装置常常浸在70~80℃的水浴中,目的是__________________________________。
(2)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_______、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在____________中。
【答案】操作麻烦、乙醇转化率低(其它合理答案均可) 使生成乙醇蒸气的速率加快 b a 冰水
【解析】
Ⅰ.课本中介绍的实验,装置比较简单,但是操作麻烦,反复用铜丝催化,产生的乙醛很少,不容易观察到乙醛。
Ⅱ.(1)甲装置常常浸在70~80℃的水浴中,目的是:升高温度,使生成乙醇蒸气的速率加快;
(2)由于乙醛易溶于水,用丁吸收乙醛易产生倒吸,在乙、丙之间接入的戊装置起防倒吸作用,则乙接b,a接丙;由于乙醛易挥发,若产物不用水吸收而是直接冷却,应将试管丁浸在冰水中。

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。
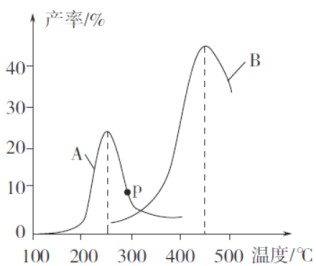
①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。