题目内容
【题目】图是某条件下N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )
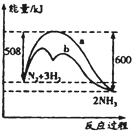
A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. 正反应的活化能大于逆反应的活化能
C. b曲线是加入催化剂时的能量变化曲线
D. 使用催化剂后反应的焓变减小,N2转化率增大
【答案】C
【解析】
A.热化学方程式要标出物质的聚集状态;
B. 根据图示,正反应的活化能是508 kJ·mol-1,逆反应的活化能是600 kJ·mol-1;
C.催化剂可以降低反应的活化能;
D、正逆反应活化能之差等于焓变,催化剂不能使平衡移动。
A.热化学方程式要标出物质的聚集状态,该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3 (g) △H=-92kJ·mol-1,故A错误;
2NH3 (g) △H=-92kJ·mol-1,故A错误;
B. 正反应的活化能是508 kJ·mol-1,逆反应的活化能是600 kJ·mol-1,所以正反应的活化能小于逆反应的活化能,故B错误;
C.催化剂可以降低反应的活化能,b曲线是加入催化剂时的能量变化曲线,故C正确;
D、正逆反应活化能之差等于焓变,催化剂不能使平衡移动,加入催化剂反应的焓变不变,N2转化率不变,故D错误。

【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体





