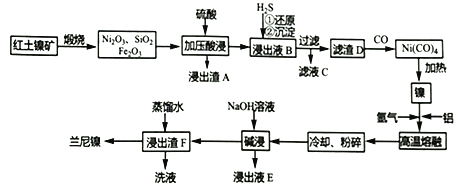
题目内容
【题目】下列说法不正确的是
A.水泥是建筑工业的基础材料,可用黏土、石灰石等原料来制得
B.二氧化硅常温下可与NaOH溶液反应
C.硅酸钠溶液中通入足量的CO2气体后,溶液中不会出现沉淀
D.利用晶体硅制作的太阳能电池可将太阳能直接转化为电能
【答案】C
【解析】
A. 生产水泥用到的原料是石灰石、粘土等,故A正确,不符合题意;
B. 二氧化硅是酸性氧化物,能与氢氧化钠溶液反应生成硅酸钠和水,故B正确,不符合题意;
C. 强酸制弱酸,盐酸的酸性强于硅酸,所以向硅酸钠溶液中滴加稀盐酸,生成溶于水的硅酸,所以溶液中会出现沉淀,故C错误,符合题意;
D. 硅是半导体,能把太阳能转化成电能,故D正确,不符合题意;
故选:C。

【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时,断裂2 mol H—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=____________(取小数点后两位,下同)。
②该反应的正反应为________(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________(填字母)。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________(填字母)。
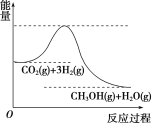
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2