题目内容
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时,断裂2 mol H—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=____________(取小数点后两位,下同)。
②该反应的正反应为________(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
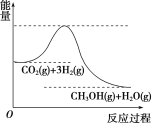
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________(填字母)。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________(填字母)。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
【答案】bd0.13 mol·L-1·min-1放0.17cd
【解析】
(1)a项,该反应容器容积可变,随着反应的进行,不论是否达到平衡,容器中的压强始终不变,无法判定反应平衡与否;b项,1molH—H键断裂,为v(正);断裂2molH—O键,为v(逆),体现了2v(正)=v(逆),能判断达到平衡;c项,按物质的量之比为1∶1充入CO和H2,则不论反应是否达到平衡,均有c(CO)=c(H2),无法判断反应达到平衡与否;d项,该反应条件为等温等压,当容器的容积不再变化,可以判定反应达到化学平衡状态。
(2)①根据表中信息,先求出v(CO),再根据速率之比和方程式中各物质前面的化学计量系数成正比,求出v(CO2)。
②根据转化率=变化量/起始量×100%,可求出CO的转化率;根据实验1和实验2中CO的转化率变化规律,可推出该反应的吸放热情况;根据“三段式”可求出该反应的平衡常数。
(3) a项,由于反应物的总能量大于生成物的总能量,正反应为放热反应,升温,平衡逆向移动;b项,充入He(g),平衡不移动;c项,将H2O(g)从体系中分离出来,减小生成物浓度,平衡正向移动;d项,体积不变,再充入1mol CO2和3 mol H2,相当于增大压强的过程,平衡右移。
(1)该反应容器容积可变,随着反应的进行,不论是否达到平衡,容器中的压强始终不变,故a项不能判断是否达到平衡,a错误;1molH—H键断裂的同时会生成2molH—O键,如果2molH—O键也同时断裂,则表明反应达到平衡状态,b正确;若起始时仅加入反应物,或按物质的量之比为1∶1充入CO和H2,则不论反应是否达到平衡,均有c(CO)=c(H2),故c项不能判断反应是否达到平衡,c错误;该反应未达到平衡时,容器的容积会发生变化,如果容器的容积不再变化,则表明反应达到化学平衡状态,d正确;正确选项bd。
(2)①实验1中6min时反应达到平衡,v(CO2)=v(CO)=(4-2.4)/(2×6) =0.13 mol·L-1·min-1;正确答案:0.13 mol·L-1·min-1 。
②由实验1、2可知,实验1中平衡时CO的转化率为(4-2.4)/4×100%=40%,实验2中平衡时CO的转化率为(2-1.6)/2×100%=20%,说明升高温度反应物的转化率降低,即正反应是放热反应;实验2中,CO与H2O均转化了0.4mol,故平衡时H2O为0.6mol,CO为1.6 mol,H2与CO2均为0.4 mol,则平衡常数K=![]() =
=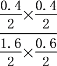 =0.17;正确答案:放; 0.17。
=0.17;正确答案:放; 0.17。
(3) a项,由于反应物的总能量大于生成物的总能量,正反应为放热反应,升温,平衡逆向移动,c(CH3OH)减小;b项,充入He(g),各物质浓度不变,平衡不移动,c(CH3OH)不变;c项,将H2O(g)从体系中分离出来,平衡正向移动,c(CH3OH)增大;d项,再充入1 mol CO2和3 mol H2,假设容器扩大一倍,达到平衡再压缩,c(CH3OH)增大;正确选项cd。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案