题目内容
20.实验室欲配制6.00mol•L-1的H2SO4溶液,现有三种不同浓度的硫酸:①240mL 1.00mol•L-1的硫酸 ②150mL 3.00mol•L-1的硫酸 ③足量的18.00mol•L-1的浓H2SO4.现有三种规格容量瓶:250mL、500mL、1000mL,配制要求:①、②两种硫酸全部用完,不足部分由③补充.请回答下列问题:
(1)选用容量瓶的规格是1000mL.
(2)需要18.00mol•L-1的浓H2SO4的体积是142.0mL.
分析 欲配制6.00mol•L-1的H2SO4溶液,因为①1.00mol•L-1的硫酸 ②3.00mol•L-1的硫酸浓度都小于6.00mol/L,所以需要用18.00nol/L的浓硫酸,设需要加18 mol/L的浓硫酸VmL,溶质的物质的量为0.24L×1mol/L+0.15L×4mol/L+0.00VL×18mol/L=0.64mol+0.018Vmol,依据C=$\frac{n}{V}$计算需要浓硫酸体积,依据三种硫酸体积和选择合适的容量瓶.
解答 解:欲配制6.00mol•L-1的H2SO4溶液,因为①1.00mol•L-1的硫酸 ②3.00mol•L-1的硫酸浓度都小于6.00mol/L,所以需要用18.00nol/L的浓硫酸,设需要加18 mol/L的浓硫酸VmL,溶质的物质的量为0.24L×1mol/L+0.15L×4mol/L+0.00VL×18mol/L=0.64mol+0.018Vmol,依据C=$\frac{n}{V}$=$\frac{0.64mol+0.018Vmol}{0.39L}$=6mol/L;
解得V=0.1420L=142.0mL,即需要浓硫酸体积为:142.0mL;
溶液体积共290mL+142mL=536mL,所以需要用1000mL的容量瓶;
故答案为:(1)1000mL;
(2)142.0mL;
点评 本题考查了有关物质的量浓度的计算,明确溶液稀释过程中溶质的物质的量不变是解题关键,题目难度不大,注意容量瓶规格的选择.

练习册系列答案
相关题目
8.标准状况下,有1.4g一氧化碳和4.4g二氧化碳组成混合气体,它的密度是( )
| A. | 1.25g/L | B. | 1.73g/L | C. | 1.96g/L | D. | 3.21g/L |
15.如果1克氧气与足量碳燃烧生成CO与CO2的混合气体,得到n个电子,则阿伏伽德罗常数是( )
| A. | $\frac{1}{n}$mol-1 | B. | 8n mol-1 | C. | 4n mol-1 | D. | n mol-1 |
5.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O 含有的分子数为 1 NA | |
| B. | 常温常压下,1.06 g Na2CO3 含有的 Na+离子数为 0.02 NA | |
| C. | 通常状况下,1 NA 个 CO2分子占有的体积为 22.4 L | |
| D. | 物质的量浓度为 0.5 mol/L 的 MgCl2溶液中,含有 Cl-个数为 1 NA |
9.6月26日是国际禁毒日,据公安部通报,目前冰毒、摇头丸、氯胺酮等新型毒品在我国有较大传播范围,吸、贩新型毒品问题十分突出,吸毒人数持续增多,滥用种类日趋多样.已知下列四种毒品的结构简式:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 1molK粉最多可以与4molH2发生加成反应 | |
| B. | 摇头丸具有两性 | |
| C. | 冰毒能与盐酸反应 | |
| D. | 适当条件下,1mol大麻最多可与3mol Br2发生反应 |
10.人生病时要合理用药.下列药品与其作用相匹配的是( )
| A. | 氢氧化铝:中和过多胃酸 | B. | 阿司匹林:消炎抗菌 | ||
| C. | 氢氧化钡:胃部透视 | D. | 医用碘酒:人体补碘 |
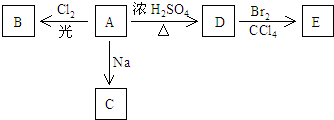
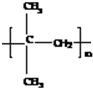 ;
; ;
; 短周期元素A、B、C、D、E、F、G原子序数依次递增,已知A和D,C和G为同一主族元素,D形成的阳离子和C形成的阴离子具有相同的核外电子排布,B原子的最外层电子数比次外层多3,G形成的化合物甲是造成酸雨的主要原因,F和A可形成化合物FA4很不稳定,F与C形成的化合物是制造光导纤维的主要原料,E的最高价氧化物的水化物能溶解于D的最高价氧化物的水化物中.请回答下列问题:
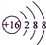
短周期元素A、B、C、D、E、F、G原子序数依次递增,已知A和D,C和G为同一主族元素,D形成的阳离子和C形成的阴离子具有相同的核外电子排布,B原子的最外层电子数比次外层多3,G形成的化合物甲是造成酸雨的主要原因,F和A可形成化合物FA4很不稳定,F与C形成的化合物是制造光导纤维的主要原料,E的最高价氧化物的水化物能溶解于D的最高价氧化物的水化物中.请回答下列问题: .画出G离子的结构示意图
.画出G离子的结构示意图