题目内容
关于盐类的水解反应的说法正确的是( )
| A.溶液呈中性的盐一定是强酸与强碱生成的盐 |
| B.含有弱酸根离子的盐的水溶液一定呈碱性 |
| C.盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小 |
| D.Na2S水解的离子方程式为:S2-+2H2O?H2S+2OH- |
A、弱酸弱碱盐水解后溶液可能为中性,如醋酸铵水解后溶液为中性,故A错误;
B、弱酸弱碱盐含有弱酸根离子,其水解后溶液可能为中性,故B错误;
C、酸、碱电离程度的相对大小决定了酸性、碱性强弱,盐溶液中越弱越水解,所以盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小,故C正确;
D、由于氢硫酸属于二元弱酸,硫离子水解分步进行,主要以第一步为主,硫化钠水解离子方程式为:S2-+H2O?HS-+OH-,故D错误;
故选:C.
B、弱酸弱碱盐含有弱酸根离子,其水解后溶液可能为中性,故B错误;
C、酸、碱电离程度的相对大小决定了酸性、碱性强弱,盐溶液中越弱越水解,所以盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小,故C正确;
D、由于氢硫酸属于二元弱酸,硫离子水解分步进行,主要以第一步为主,硫化钠水解离子方程式为:S2-+H2O?HS-+OH-,故D错误;
故选:C.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
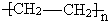 的单体是______.
的单体是______.