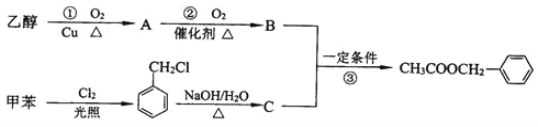
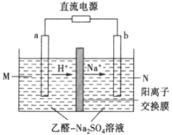
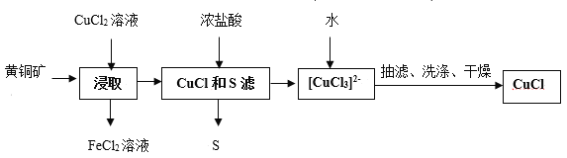
题目内容
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
Ⅰ.C(s)+CO2(g)![]() 2CO(g) ΔH=+172.5kJ·mol-1
2CO(g) ΔH=+172.5kJ·mol-1
Ⅱ.CO(g)+2CuO(s)![]() Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
请回答:
(1)一定温度下,向5L恒容密闭容器中加入1molCO和2molCuO,发生反应Ⅱ,2min时达到平衡,测得容器中CuO的物质的量为0.5mol。
①0-2min内,用CO表示的反应速率v(CO)=___。
②CO2的平衡体积分数φ=___。
(2)向5L密闭容器中加入1molC和1molCO2,发生反应Ⅰ。CO2、CO的平衡分压(p)与温度(T)的关系如图所示(平衡分压=物质的量分数×总压强)。
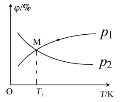
①能表示CO2的平衡分压与温度关系的曲线为___(填"p1”或“p2”),理由是___。
②温度为T1时,该反应的平衡常数K=___;温度升高,K___(填“变小”、“变大”或“不变”)
③实验测得,v正=v(CO2)消耗=k正c(CO2),v逆=v(CO)消耗=k逆c2 (CO),k正、k逆为速率常数,受温度影响,则温度为T1时,k正/k逆=___。
【答案】0.075mol/(L·min) 75% p2 该反应为吸热反应,温度升高,平衡正向移动,CO2的平衡平衡体积分数减小,平衡分压减小 ![]() mol/L 变大 K=
mol/L 变大 K=![]() mol/L
mol/L
【解析】
(1)一定温度下,向5L恒容密闭容器中加入1molCO和2molCuO,发生反应Ⅱ,2min时达到平衡,测得容器中CuO的物质的量为0.5mol。
CO(g)+2CuO(s)![]() Cu2O(s)+CO2(g)
Cu2O(s)+CO2(g)
开始时的量(mol) 1 2 0
改变的量(mol) 0.75 1.5 0.75
平衡时的量(mol) 0.25 0.5 0.75
①0-2min内,用CO表示的反应速率v(CO)=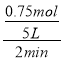 =0.075mol/(L·min);
=0.075mol/(L·min);
②CO2的平衡体积分数φ=![]() =75%;
=75%;
(2)①该反应为吸热反应,温度升高,平衡正向移动,CO2的平衡平衡体积分数减小,平衡分压减小,故能表示CO2的平衡分压与温度关系的曲线为p2;
②温度为T1时,CO2、CO的平衡分压(p)相等,则物质的量相等;设CO2的转化率为x,则1-x=2x,解得x=![]() mol,即CO2、CO的平衡浓度均为
mol,即CO2、CO的平衡浓度均为![]() mol/L,该反应的平衡常数K=
mol/L,该反应的平衡常数K=![]() =
=![]() mol/L;
mol/L;
反应C(s)+CO2(g)![]() 2CO(g) ΔH=+172.5kJ·mol-1为吸热反应,温度升高,平衡正向移动,K变大;
2CO(g) ΔH=+172.5kJ·mol-1为吸热反应,温度升高,平衡正向移动,K变大;
③实验测得,v正=v(CO2)消耗=k正c(CO2),则k正=![]() ;v逆=v(CO)消耗=k逆c2 (CO),则k逆=
;v逆=v(CO)消耗=k逆c2 (CO),则k逆=![]() ;平衡时v正= v逆,则温度为T1时,k正/k逆=
;平衡时v正= v逆,则温度为T1时,k正/k逆=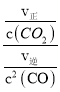 =
=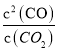 =K=
=K=![]() mol/L。
mol/L。

 阅读快车系列答案
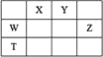
阅读快车系列答案【题目】下列反应中的能量转化不正确的是( )
选项 | 化学反应 | 能量转化形式 |
A | CH4+2O2 | 化学能转化成热能 |
B | Pb+PbO2+2H2SO4 | 使用时放电,电能转化成化学能 |
C | mH2O+nCO2 | 光能转化成化学能 |
D | CaCO3 | 热能转化成化学能 |
A.AB.BC.CD.D
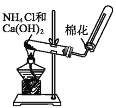
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是

选项 | ①试剂 | ①中现象 | 解释 |
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性: H2SO3 >H2SiO3 |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成 白色BaSO3沉淀 |
A.AB.BC.CD.D