��Ŀ����
����Ŀ����������һ�������˿ڵĽ�����衣���������ijɷ��ж��֣����ᱽ���������е�һ�֣������Դ���������ȡ��Ҳ�����üױ����Ҵ�Ϊԭ�Ͻ����˹��ϳɡ�һ�ֺϳ�·�����£�
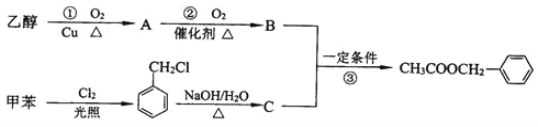
��1��A������Ϊ___��C�Ľṹ��ʽΪ___��
��2��д����Ӧ�ٵĻ�ѧ����ʽ___��
��3����Ӧ�۵ķ�Ӧ����Ϊ___��
��4��Cͨ�������ֲ�ͬ���ķ�����ͬ���칹�壬��д�������ֲ�ͬ����ͬ���칹��Ľṹ��ʽ����дһ�֣�___��___��
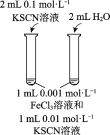
��5����Ӧ__������ţ�ԭ�ӵ�����������Ϊ100%��������ɫ��ѧ�ġ�
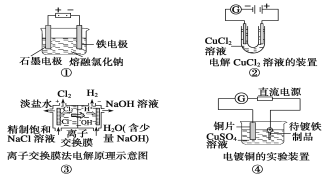
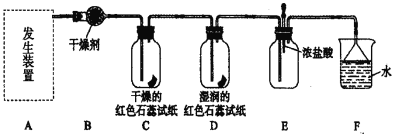
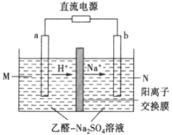
��6��һ�ִ�����Ũ����ȩ��ˮ�ķ���������Ĥ��ⷨ����ԭ����ͼ��ʾ���������ҺΪһ��Ũ�Ⱥ���ȩ��Na2SO4��Һ��������ȩ�������缫�քeת��Ϊ�Ҵ������ᡣд�������缫ʽ��___��
���𰸡���ȩ ![]() 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO+2H2O ȡ����Ӧ����������Ӧ��
2CH3CHO+2H2O ȡ����Ӧ����������Ӧ�� ![]()
![]() �� CH3CHO-2e-+H2O=CH3COOH+2H+
�� CH3CHO-2e-+H2O=CH3COOH+2H+
��������
CH3CH2OH��Cu��Ag�������������¿ɱ�������AΪCH3CHO��CH3CHO��һ������������BΪCH3COOH���ױ��ڹ�������������������ȡ����Ӧ����![]() ���ڼ���������ˮ������CΪ
���ڼ���������ˮ������CΪ![]() ��
��![]() ��CH3COOH��һ�������·���������Ӧ������
��CH3COOH��һ�������·���������Ӧ������![]() ��
��
��1��AΪCH3CHO��A������Ϊ��ȩ��C�Ľṹ��ʽΪ![]() ��
��
��2����Ӧ��ΪCH3CH2OH��Cu��Ag�������������¿ɱ�����ΪCH3CHO�ķ�Ӧ����Ӧ�ٵĻ�ѧ����ʽ2CH3CH2OH+O2![]() 2CH3CHO+2H2O ��
2CH3CHO+2H2O ��
��3����Ӧ��Ϊ![]() ��CH3COOH��һ�������·���������Ӧ������
��CH3COOH��һ�������·���������Ӧ������![]() ��ҲΪȡ����Ӧ��������Ӧ�۵ķ�Ӧ����Ϊȡ����Ӧ����������Ӧ����
��ҲΪȡ����Ӧ��������Ӧ�۵ķ�Ӧ����Ϊȡ����Ӧ����������Ӧ����
��4��Cͨ�������ֲ�ͬ���ķ�����ͬ���칹�壬CΪ![]() ����Ӧ��ͬ���칹���Ϊ�������࣬�����ֲ�ͬ����ͬ���칹��Ľṹ��ʽΪ
����Ӧ��ͬ���칹���Ϊ�������࣬�����ֲ�ͬ����ͬ���칹��Ľṹ��ʽΪ![]() ��
��![]() ��
��
��5����Ӧ�٢۶���ˮ���ɣ���Ӧ��Ϊ2CH3CHO+O2��2CH3COOH��ԭ�ӵ�����������Ϊ100%��������ɫ��ѧ��Ҫ��
��6��һ�ִ�����Ũ����ȩ��ˮ�ķ���������Ĥ��ⷨ����ԭ����ͼ��ʾ���������ҺΪһ��Ũ�Ⱥ���ȩ��Na2SO4��Һ��������ȩ�������缫�քeת��Ϊ�Ҵ������ᡣCH3CHO������ʧ���ӣ�����������CH3COOH�������缫ʽ��CH3CHO-2e-+H2O=CH3COOH+2H+��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ʵ�鷽�������ﵽ��ӦĿ�ĵ���
A | B | C | D | |
Ŀ�� | �Ƚ�̼�����̼�����ˮ��̶� | �о�Ũ�ȶԻ�ѧƽ���Ӱ�� | �Ƚϲ�ͬ�����Ի�ѧ��Ӧ���ʵ�Ӱ�� | �Ƚ�̼�ᡢ��������������ǿ�� |
ʵ�鷽�� |
|
|
|
|
A. AB. BC. CD. D