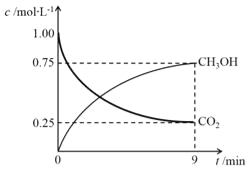
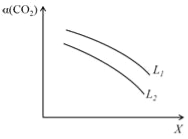
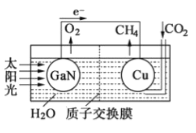
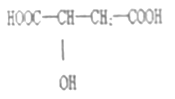
题目内容
【题目】将6.5 g锌投入100 mL 2 mol/L的稀硫酸(已知溶液密度为1.12 g/cm3)中充分反应。试计算
(1)产生的氢气在标准状况下的体积。
(2)反应后所得溶液的质量。
(3)现有2 mol/L的稀盐酸和稀硫酸各100 mL,分别加入等质量的铁,反应后生成的气体在标准状况下的体积比为2∶3,求加入铁的质量。
【答案】(1)2.24 L(2分) (2)118.3 g(2分) (3)8.4 g(3分)
【解析】
试题分析:(1)先由![]() 、cV计算两种反应物的n分别为
、cV计算两种反应物的n分别为![]() mol = 0.1mol、100×10-3×2 mol = 0.2 mol,再根据化学方程式Zn+H2SO4=ZnSO4+H2↑可知,两反应物不是恰好完全反应,而是Zn完全反应,H2SO4一半反应,另一半过量,因此应根据锌计算氢气的n为0.1mol,最后根据nVm可知氢气的V为0.1×22.4L=2.24L;(2)先由ρV、nM计算稀硫酸和氢气的质量分别为100×1.12g = 112g、0.1×2g = 0.2g,反应前总质量为(6.5+112)g=118.5g,反应过程中只逸出0.2g氢气,因此反应后所得溶液质量为(118.5-0.2)g=118.3g;(3)先由cV计算两种酸的n均为100×10-3×2 mol = 0.2 mol,由题意及化学方程式Fe+2HCl=FeCl2+H2↑、Fe+H2SO4=FeSO4+H2↑推断,前一反应中Fe过量HCl不足且生成的氢气较少,后一反应中Fe不足H2SO4过量且生成的氢气较多,设加入x mol Fe,则前一反应根据完全反应的HCl可计算出生成氢气为0.2mol/2=0.1mol,后一反应根据完全反应的Fe可计算出生成氢气为xmol;再根据nVm可知,两反应生成的氢气体积分别为0.1×22.4L=2.24L、22.4xL;再由题意可知,
mol = 0.1mol、100×10-3×2 mol = 0.2 mol,再根据化学方程式Zn+H2SO4=ZnSO4+H2↑可知,两反应物不是恰好完全反应,而是Zn完全反应,H2SO4一半反应,另一半过量,因此应根据锌计算氢气的n为0.1mol,最后根据nVm可知氢气的V为0.1×22.4L=2.24L;(2)先由ρV、nM计算稀硫酸和氢气的质量分别为100×1.12g = 112g、0.1×2g = 0.2g,反应前总质量为(6.5+112)g=118.5g,反应过程中只逸出0.2g氢气,因此反应后所得溶液质量为(118.5-0.2)g=118.3g;(3)先由cV计算两种酸的n均为100×10-3×2 mol = 0.2 mol,由题意及化学方程式Fe+2HCl=FeCl2+H2↑、Fe+H2SO4=FeSO4+H2↑推断,前一反应中Fe过量HCl不足且生成的氢气较少,后一反应中Fe不足H2SO4过量且生成的氢气较多,设加入x mol Fe,则前一反应根据完全反应的HCl可计算出生成氢气为0.2mol/2=0.1mol,后一反应根据完全反应的Fe可计算出生成氢气为xmol;再根据nVm可知,两反应生成的氢气体积分别为0.1×22.4L=2.24L、22.4xL;再由题意可知,![]() ,解得:x=0.15;最后由nM计算可得加入的铁质量为0.15×56g=8.4g。
,解得:x=0.15;最后由nM计算可得加入的铁质量为0.15×56g=8.4g。

 名校课堂系列答案
名校课堂系列答案