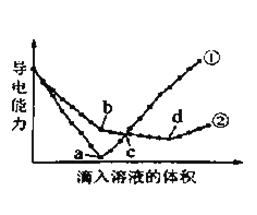
题目内容
【题目】常温下,在27.5 g水中溶解12.5 g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21 g/cm3,求:
(1)该溶液中阴阳离子的总物质的量(结果保留三位有效数字,下同);
(2)取出20.0 mL该溶液,配成溶度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
【答案】(1)0.100 mol (2)30.3 mL
【解析】
试题分析:(1)根据题意,先由![]() 计算CuSO4·5H2O的n为
计算CuSO4·5H2O的n为![]() mol = 0.0500 mol,再写电离方程式:CuSO4·5H2O =Cu2+ + SO42- + 5 H2O并由其中Cu2+、SO42-、CuSO4·5H2O的系数之比等于n之比可知,Cu2+、SO42-的n分别为0.0500 mol、0.0500 mol,二者之和为0.100 mol;(2)先由题意计算饱和溶液中溶质的质量分数为
mol = 0.0500 mol,再写电离方程式:CuSO4·5H2O =Cu2+ + SO42- + 5 H2O并由其中Cu2+、SO42-、CuSO4·5H2O的系数之比等于n之比可知,Cu2+、SO42-的n分别为0.0500 mol、0.0500 mol,二者之和为0.100 mol;(2)先由题意计算饱和溶液中溶质的质量分数为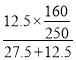 ×100% = 20%,再由ρVw= m可知,20.0 mL饱和 CuSO4溶液中溶质(CuSO4)的m为1.21×20.0×20% g,然后设稀释溶液的体积为x mL且根据cV = n、nM = m可知,溶质的m为1.00×x×10-3×160 g,最后根据稀释前后溶质的质量不变可知,1.21×20.0×20% = 1.00×x×10-3×160,解得:x = 30.25 ≈ 30.3。
×100% = 20%,再由ρVw= m可知,20.0 mL饱和 CuSO4溶液中溶质(CuSO4)的m为1.21×20.0×20% g,然后设稀释溶液的体积为x mL且根据cV = n、nM = m可知,溶质的m为1.00×x×10-3×160 g,最后根据稀释前后溶质的质量不变可知,1.21×20.0×20% = 1.00×x×10-3×160,解得:x = 30.25 ≈ 30.3。

【题目】汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=﹣746.5kJmol-1(条件为使用催化剂)
2CO2(g)+N2(g)△H=﹣746.5kJmol-1(条件为使用催化剂)
已知:2C(s)+O2(g)![]() 2CO(g)△H=﹣221.0kJmol-1
2CO(g)△H=﹣221.0kJmol-1
C(s)+O2(g)![]() CO2(g)△H=﹣393.5kJmol-1
CO2(g)△H=﹣393.5kJmol-1
则N2(g)+O2(g)=2NO(g) △H = kJmol-1。
(2)T ℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
则c2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比![]() 的变化曲线如图1所示。
的变化曲线如图1所示。
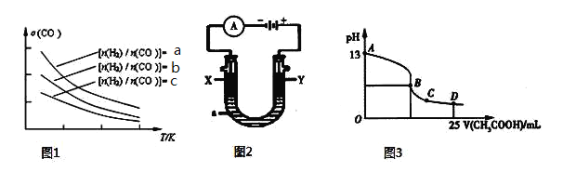
① a、b、c按从大到小的顺序排序为 。
② 根据图象可以判断该反应为 反应(填吸热或放热)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
① 负极的电极反应式为 。
② 以上述电池为电源,通过导线连接成图2。若X、Y为石墨,a为2 L 0.1 mol/L KCl溶液电解一段时间后,取25 mL 上述电解后的溶液,滴加0.4 mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图2计算,上述电解过程中消耗一氧化碳的质量为 g。