题目内容
【题目】Ⅰ.过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式_______________
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是______________
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入质量分数为30%70%的过氧化氢溶液中,则该反应的化学方程式_______
Ⅱ. 某厂废水中含KCN,其浓度为650mgL1现用氯氧化法处理,发生如下反应(其中N均为3价):
(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是____________________.
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
___KOCN+___KOH+___ Cl2→_____CO2+_____N2+_____KCl+______ H2O
(3)若将10m3含KCN的浓度为650mgL1的废水中KCN氧化除去,需要标准状况下的氯气的体积为______________________L.
【答案】H2O2+2Fe2++2H+═2Fe3++2H2O BaO2 Ca(OH)2+2HCHO+2H2O2=Ca(HCOO)2+4H2O C 2 4 3 2 1 6 2 5600
【解析】
Ⅰ(1)在酸性条件下H2O2氧化氯化亚铁生成铁离子和水。
(2)实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得,说明生成了沉淀,应该为硫酸钡沉淀。
(3)实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入质量分数为30%70%的过氧化氢溶液中反应生成甲酸钙和水。
Ⅱ(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O,KCN中碳+2价,化合价升高变为KOCN中碳+4价,即得被氧化的元素是C。
(2)投入过量液氯,氯化合价降低,1个氯气降低两个价态,KOCN中一个氮化合价升高3个价态,得到1个氮气化合价升高6个价态,根据化合价升降守恒得到系数,氯气前面配3,氮气前面系数配1,再根据守恒配平。
(3)根据KCN+Cl2+2KOH═KOCN+2KCl+H2O和2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O 知KCN和氯气的反应的物质的量之比为1:2.5,10m3含KCN的浓度为650mgL1的废水中KCN物质的量=mM=![]() =10mol,故氯气的物质的量为25mol得标准状况下的氯气的体积。
=10mol,故氯气的物质的量为25mol得标准状况下的氯气的体积。
Ⅰ(1)在酸性条件下H2O2氧化氯化亚铁生成铁离子,其离子反应方程式H2O2+2Fe2++2H+═ 2Fe3++ 2H2O,故答案为:H2O2+2Fe2++2H+═ 2Fe3++ 2H2O。
(2)实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得,说明生成了沉淀,则上述最适合的过氧化物是BaO2,故答案为:BaO2。
(3)实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入质量分数为30%70%的过氧化氢溶液中反应生成甲酸钙和水,则该反应的化学方程式Ca(OH)2+2HCHO+2H2O2= Ca(HCOO)2+4H2O,故答案为:Ca(OH)2+2HCHO+2H2O2= Ca(HCOO)2+4H2O。
Ⅱ(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O,KCN中碳+2价,化合价升高变为KOCN中碳+4价, 被氧化的元素是C,故答案为:C。
(2)投入过量液氯,氯化合价降低,1个氯气降低两个价态,KOCN中一个氮化合价升高3个价态,得到1个氮气化合价升高6个价态,根据化合价升降守恒得到系数,氯气前面配3,氮气前面系数配1,再根据守恒配平,2 KOCN + 4 KOH+3Cl2 = 2CO2 + 1 N2 + 6KCl + 2 H2O,故答案为:2;4;3;2;1;6;2。
(3)根据KCN+Cl2+2KOH═KOCN+2KCl+H2O和2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O 知KCN和氯气的反应的物质的量之比为1:2.5,10m3含KCN的浓度为650mgL1的废水中KCN物质的量=mM=![]() =10mol,故氯气的物质的量为25mol,则标准状况下的氯气的体积V=25mol×22.4L/mol=5600L,故答案为5600。
=10mol,故氯气的物质的量为25mol,则标准状况下的氯气的体积V=25mol×22.4L/mol=5600L,故答案为5600。

【题目】某混合溶液中可能大量含有的离子如下表所示:
阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
阴离子 | Cl-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
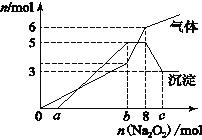
(1)该溶液中一定含有的阳离子是________________________________,其对应物质的量浓度之比为 ____________,溶液中一定不存在的阴离子是_______________________。
(2)写出沉淀减少的离子方程式 ________________________________________________。