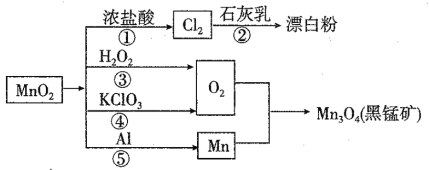
题目内容
【题目】I.字母 A~K 代表常见物质,在一定条件下能发生如图所示变化
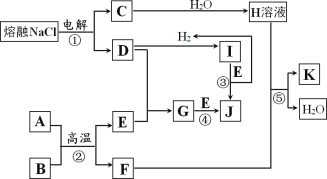
已知:反应②中A为红棕色粉末,B为金属单质,且n(A):n(B)=1:2,反应③和反应④均在水溶液中进行。
(1)保存 J 的方法是:_____。
(2)写出反应②的化学方程式:_____。
II.某研究性学习小组的同学以 Fe(NO3)3溶液来探究 Fe3+能否氧化 Ag 为题。他们选用少量的Fe(NO3)3 溶液与做过银镜反应的试管进行实验。现象:银镜部分溶解,试管上方出现少量淡淡的红棕色气体。
(1)出现少量淡淡的红棕色气体,该气体是_____。
(2)若 Fe3+能否氧化 Ag,只需证明:_____方法是:_____
Ⅲ. 铁红是一种红色颜料,其成分是 Fe2O3 ,将一定量的铁红溶于 180mL 5mol·L-1 盐酸中,在加入一定量铁粉恰好溶解,收集到 3.36L(标准状况)气体。
(1)按反应顺序写出离子方程式_____
(2)反应后的溶液中一定没有 Fe3+,理由是_____
(3)参加反应的铁粉的质量为_____g。
【答案】加入少量盐酸和铁粉 Fe2O3+2Al![]() 2Fe+Al2O3 NO2 溶液中存在Fe2+ 取溶液少许,滴加酸性KMnO4溶液,红色褪去证明含Fe2+ Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑ 氧化性:Fe3+>H+,H+参与了反应,说明Fe3+已反应完全 14
2Fe+Al2O3 NO2 溶液中存在Fe2+ 取溶液少许,滴加酸性KMnO4溶液,红色褪去证明含Fe2+ Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑ 氧化性:Fe3+>H+,H+参与了反应,说明Fe3+已反应完全 14
【解析】
Ⅰ.熔融NaCl电解生成Na和Cl2,由于D能和H2反应,则C为Na,D为Cl2;D和H2反应生成I,则I为HCl;C与H2O反应生成H溶液,则H为NaOH;D与E反应生成G,G还能和E反应生成J,而I与E反应生成H2和J,符合条件的E为Fe,则G为FeCl3,J为FeCl2;A为红棕色粉末,B为金属单质,且n(A):n(B)=1:2,高温反应生成Fe和F,符合条件的为铝热反应,则A为Fe2O3,B为Al,F为Al2O3;NaOH溶液与Al2O3反应生成NaAlO2和H2O,则K为NaAlO2;据此分析解答;
Ⅱ.(1)根据元素守恒分析可能出现的红棕色气体;
(2)Fe3+若能氧化Ag,则自身被还原为Fe2+;
Ⅲ.Fe2O3先与H+反应生成Fe3+,加入铁粉后Fe3+与Fe反应生成Fe2+,由于生成了气体,则Fe与H+反应生成H2,据此分析解答。
Ⅰ.熔融NaCl电解生成Na和Cl2,由于D能和H2反应,则C为Na,D为Cl2;D和H2反应生成I,则I为HCl;C与H2O反应生成H溶液,则H为NaOH;D与E反应生成G,G还能和E反应生成J,而I与E反应生成H2和J,符合条件的E为Fe,则G为FeCl3,J为FeCl2;A为红棕色粉末,B为金属单质,且n(A):n(B)=1:2,高温反应生成Fe和F,符合条件的为铝热反应,则A为Fe2O3,B为Al,F为Al2O3;NaOH溶液与Al2O3反应生成NaAlO2和H2O,则K为NaAlO2;
(1)J为FeCl2,Fe2+容易水解,且易被氧化,故保存方法是:加入少量盐酸和铁粉;
(2)反应②为铝热反应,化学方程式为Fe2O3+2Al![]() 2Fe+Al2O3;
2Fe+Al2O3;
Ⅱ.(1)根据元素守恒,可能出现的红棕色气体只有NO2;
(2)Fe3+若能氧化Ag,则自身被还原为Fe2+,只需证明Fe2+的存在即可,方法是:取溶液少许,滴加酸性KMnO4溶液,红色褪去证明含Fe2+;
Ⅲ.Fe2O3先与H+反应生成Fe3+,加入铁粉后Fe3+与Fe反应生成Fe2+,由于生成了气体,则Fe与H+反应生成H2;
(1)相关的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑;
(2)经过分析可知,反应后的溶液中一定没有Fe3+,理由是:氧化性:Fe
(3)氢气物质的量为![]() =0.15mol;
=0.15mol;
![]()
根据氯原子守恒,所以氯化铁的物质的量为![]() ×(0.18L×5mol/L0.3mol)=0.2mol;
×(0.18L×5mol/L0.3mol)=0.2mol;
![]()
所以参加反应的铁粉的质量为(0.15mol+0.1mol)×56g/mol=14g。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案