题目内容
【题目】某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下图所示:
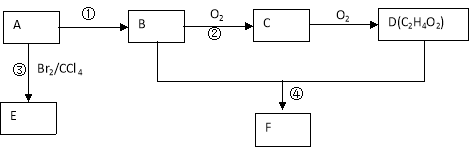
(1)A的结构式为 , D中官能团的名称为 。
(2)反应①的反应类型是 ,反应③的化学方程式为 。
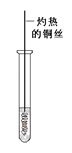
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如右上图所示)。重复操作2-3次,观察到的现象是__________。该反应的化学方程式为 。
(4)D与碳酸氢钠溶液反应的离子方程式为 。
(5)B、D在浓硫酸的作用下实现反应④,实验装置如右图所示:
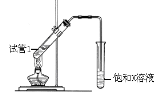
图中X的化学式为_________。浓硫酸的作用是 。
试管Ⅰ中在加热前应加_______,防止液体暴沸。导管末端为伸入小试管液面下的原因是__________。该反应的化学方程式为 。分离产物F的方法是__________。
【答案】(1)![]() 羧基
羧基
(2)加成;CH2=CH2 + Br2→CH2BrCH2Br
(3)铜丝由黑色变红色,产生刺激性气味。
![]()
(4)CH3COOH+HCO3-→CH3COO-+H2O+CO2↑
(5)Na2CO3;催化剂、吸水剂;碎瓷片;防倒吸;
CH3COOH + HOCH2CH3 ![]() CH3COOCH2CH3 +H2O 分液
CH3COOCH2CH3 +H2O 分液
【解析】
试题分析:A是一种气态烃在标准状况下的密度是1.25g/L摩尔质量=1.25g/L×22.4L/mol=28g/mol其产量是衡量一个国家石油化工发展水平则A为CH2=CH2 ;B氧化生成C,C氧化生成D,B和D都是生活中常见的有机物,由D的分子式可知B为CH3CH2OH,C为CH3CHO,D为CH3COOH,故反应①是乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成乙酸乙酯则F为CH3COOCH2CH3,乙烯与溴发生加成反应生成1,2-二溴乙烷;(1)CH2=CH2的结构式为![]() ,CH3COOH中官能团的名称为羧基。
,CH3COOH中官能团的名称为羧基。
(2)反应①是乙烯与水发生加成反应生成乙醇反应;
③是乙烯与溴发生加成反应生成12-二溴乙烷反应,反应③的化学方程式为
CH2=CH2 + Br2→CH2BrCH2Br。
(3)反应②在Cu做催化剂的条件下进行该实验的步骤是将红亮的铜丝置于酒精灯上加热待铜丝变为黑色时迅速将其插入到装有B的试管中(如图2所示).重复操作2-3次观察到的现象是:铜丝由黑色变红色产生刺激性气味该反应的化学方程式为![]() 。
。
(4)CH3COOH与碳酸氢钠溶液反应生成醋酸钠和二氧化碳,离子方程式为CH3COOH+HCO3-→CH3COO-+H2O+CO2↑。
(5) CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成乙酸乙酯:利用饱和碳酸钠溶液收集乙酸乙酯,X的化学式为Na2CO3。浓硫酸的作用是催化剂、吸水剂。试管Ⅰ中在加热前应加碎瓷片,防止液体暴沸。导管末端为伸入小试管液面下的原因是防倒吸。该反应的化学方程式为CH3COOH + HOCH2CH3![]() CH3COOCH2CH3 +H2O。乙酸乙酯难溶于水,分离乙酸乙酯的方法是分液。
CH3COOCH2CH3 +H2O。乙酸乙酯难溶于水,分离乙酸乙酯的方法是分液。

 备战中考寒假系列答案
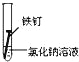
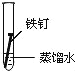
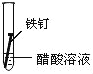
备战中考寒假系列答案【题目】全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如表实验.
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验 内容 |
|
|
|
请回答:
①在一周的观察过程中,他发现实验序号为 的试管中铁钉锈蚀速度最慢..
②下列防止钢铁锈蚀的措施不合理的是 (填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由 腐蚀造成的.