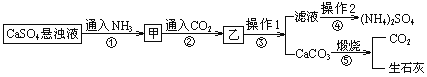
题目内容
【题目】一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)Z(g),经60s达到平衡,生成0.3mol Z,下列正确的是( )
A.60s内以X浓度变化表示的反应速率为0.001 mol/(L?s)
B.将容器体积变为20L,Z的平衡浓度变为原来的 ![]()
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的正反应为吸热反应
【答案】A
【解析】解:A.达到平衡时Z的平均反应速率为:v(Z)= ![]() =0.0005mol/(Ls),反应速率与化学计量数成正比,则60s内以X浓度变化表示的反应速率为:v(X)=2v(Z)=0.001 mol/(Ls),故A正确; B.将容器容积变为20L时,物质的压强减小,平衡向体积增大的方向移动,即逆向移动,Z的物质的量减小,即小于0.3mol,Z的新平衡浓度将小于原平衡浓度的
=0.0005mol/(Ls),反应速率与化学计量数成正比,则60s内以X浓度变化表示的反应速率为:v(X)=2v(Z)=0.001 mol/(Ls),故A正确; B.将容器容积变为20L时,物质的压强减小,平衡向体积增大的方向移动,即逆向移动,Z的物质的量减小,即小于0.3mol,Z的新平衡浓度将小于原平衡浓度的 ![]() ,故B错误;
,故B错误;
C.增大压强后,平衡向着正反应方向移动,则Y的转化率增大,故C错误;
D.若升高温度,X的体积分数增大,说明逆反应为吸热反应,则正反应为放热反应,故D错误;
故选A.
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

练习册系列答案
相关题目
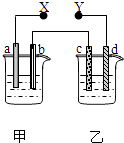
【题目】如图X、Y分别是直流电源的两极,通电后发现a极板质量增加,d极板有无色无臭的气体放出,符合这一情况的是( )
选项 | a 极板 | d极板 | X极板 | 乙中溶液 |
A | 锌 | 铜 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A.A
B.B
C.C
D.D