题目内容
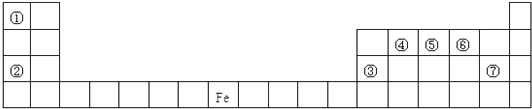
【题目】六种短周期元素在周期表中的相对位置如下所示,其中E元素原子核外电子总数是其最外层电子数的3倍。关于元素周期表及这六种元素性质,请回答:

(1)这六种元素的氢化物中,最稳定的是___________.(写化学式);
(2)AF2的结构式为_____________.
(3)在一定条件下,由B单质与H2反应生成1 molG气体时,放出的热量为46.2 kJ,写出该反应的热化学方程式:_____________________.
(4)工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式__________________________.该反应中被氧化的G与参与反应的G的质量之比__________.
(5)F的单质可由其氧化物与氢化物反应生成,写出该反应的化学方程式:__________.
【答案】 H2O S=C=S N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol 8NH3+3Cl2=6NH4Cl+N2 1:4 2H2S+SO2=3S+2H2O
2NH3(g) ΔH=-92.4 kJ/mol 8NH3+3Cl2=6NH4Cl+N2 1:4 2H2S+SO2=3S+2H2O
【解析】由短周期元素相对位置,可知A、B、C处于第二周期,D、E、F处于第三周期,E元素原子核外电子总数是其最外层电子数的3倍,设核外最外层电子数为x,则有(2+8+x)=3x,解得x=5,则E为P元素,可知A为碳元素,B为N元素,C为O元素,D为Si,F为S元素。
(1)这六种元素中O元素非金属性最强,故氢化物中,最稳定的是H2O,故答案为:H2O;
(2)CS2与CO2结构相似,结构式为S=C=S,故答案为:S=C=S;
(3)在一定条件下,由氮气与H2反应生成1molG(氨气)时,放出的热量为46.2kJ,该反应的热化学方程式:N2(g)+3H2(g)2NH3(g)△H=-92.4 kJ/mol,故答案为:N2(g)+3H2(g)2NH3(g) △H=-92.4 kJ/mol;
(4)工业上用G(氨气)检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,反应生成氯化铵与氮气,反应方程式为:8NH3+3Cl2═6NH4Cl+N2,反应中被氧化的氨气与参与反应的氨气的质量之比为2:8=1:4,故答案为:8NH3+3Cl2═6NH4Cl+N2;1:4;
(5)F(硫)的单质可由其氧化物与氢化物反应生成,该反应的化学方程式:2H2S+SO2=3S↓+2H2O,故答案为:2H2S+SO2=3S↓+2H2O。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡.其初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.该反应可表示为X+3Y2Z
B.反应达到平衡时,X的转化率为50%
C.前5min 以Y表示的平均反应速率为υ(Y)=0.01 molL﹣1min﹣1
D.增大压强使平衡向生成Z的方向移动
【题目】表为元素周期表的一部分,针对表中的①~⑨九种元素,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
4 | ⑧ | ⑨ |
(1)⑨的元素符号是 .
(2)在这些元素中,化学性质最不活泼的原子结构示意图为 .
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是(填化学式,下同),碱性最强的是 , 显两性的是 .
(4)将元素①与氢元素组成的最简单有机物和⑥的单质按1:1混合后的气体在光照条件下放置一段时间,最多能得到产物.
(5)用电子式表示④和⑥两元素形成化合物的过程为 .