��Ŀ����
����Ŀ��ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飮
��1�����ơ������ظ� 1mol �ֱ�Ͷ�뵽��������ͬŨ�ȵ������У���Ԥ��ʵ������������ ��Ӧ����ҵĵ����� �� �����ᷴӦ���������������� ��
��2���� Na2S ��Һ��ͨ���������ֻ�ɫ���ǣ���֤�� Cl �ķǽ����Ա� S ǿ����Ӧ���ӷ���ʽ Ϊ ��
��3��������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯���ɣ����� A ������Ϊ �� װ�� D ������Ϊ�� 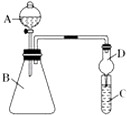
����Ҫ֤���ǽ����ԣ�Cl��I���� A �м�Ũ���ᣬB �м� KMnO4��KMnO4��Ũ���᳣���·�Ӧ������������C �мӵ��۵⻯�ػ����Һ���۲쵽 C ����Һ��������֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�������Һ����β����
����Ҫ֤���ǽ����ԣ�C��Si������ A �м����ᡢB �м� CaCO3��C �м� Na2SiO3 ��Һ���۲쵽 C ����Һ��������֤�������е�ͬѧ��Ϊ������лӷ��ԣ��ɽ��� C �и���ʵ�飬Ӧ����װ�ü�����װ����Һ��ϴ��ƿ��
���𰸡�
��1���أ���
��2��S2��+Cl2�TS��+2Cl��
��3����Һ©������ֹ������������NaOH���а�ɫ�������ɣ�����NaHCO3
���������⣺��1������������˳��Ϊ���أ��ƣ�þ������������ͬ�����������ᷴӦ��ҵ��Ǽأ�����1mol������Ҫ�õ�2mol���ӣ�1mol�ء��ƶ�ʧȥ1mol���ӣ�1molþʧȥ2mol���ӣ���1mol��ʧȥ3mol���ӣ������������������ǽ����������Դ��ǣ��أ�������2������������ǿ�����ʣ����������ܹ��������ӷ�Ӧ������Ӧ�����ӷ���ʽΪ��S2��+Cl2�TS��+2Cl�� �� ���Դ��ǣ�S2��+Cl2�TS��+2Cl������3������AΪ��Һ©�������θ����D�ܹ���ֹ���������Ա���C��Һ�������ƿ�У����Դ��ǣ���Һ©������ֹ������
��KMnO4��Ũ���᳣���·�Ӧ���������������ܹ��������������ɵⵥ�ʣ��ⵥ���������۱����ɫ��������һ���ж����壬�������β�����գ������ܹ�������������Һ��Ӧ������ʹ������������Һ���ն�������������Դ��ǣ�������NaOH�����Ȼ�����лӷ��ԣ�����ʵ��������Ҫ��������̼�е��Ȼ�������������Ȼ�����̼�����Ʒ�Ӧ����������̼����Ӧ��������B��C֮������װ�б���NaHCO3��Һ��ϴ��ƿ�����Դ��ǣ��а�ɫ�������ɣ�����NaHCO3 ��
�����㾫����������Ĺؼ���������ǽ�����Ԫ�����ڱ��е�λ�ü������ʵݱ�Ĺ��ɵ����֪ʶ��������Ŀǰ��֪��112��Ԫ���У��ǽ���Ԫ����22�֣���H��ǽ���Ԫ�ض�λ�����ڱ������Ϸ���H�����Ϸ�����F�Ƿǽ�������ǿ��Ԫ�أ�

����Ŀ��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1��7��10��5molL��1 | K1=4��4��10��7molL��1 K2=5��6��10��11molL��1 | 3��0��10��8 molL��1 |
��ش��������⣺
��1��ͬŨ�ȵ�CH3COO����HCO3����CO32����ClO�����H+��������ǿ������˳��Ϊ_____��
��2��������0��1molL��1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����_______������ĸ��ţ���ͬ����
A��c��H+�� B��![]() C��c��H+��c��OH����
C��c��H+��c��OH����
D��![]() E��
E�� 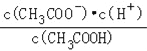
�����߸���Һ�¶ȣ������Ǵ���ӷ���������5�ֱ���ʽ�������������_____��
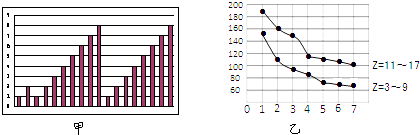
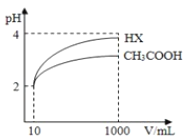
��3�����Ϊ10mL pH=2�Ĵ�����Һ��һԪ��HX��Һ�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ����HX�ĵ���ƽ�ⳣ��_____��������������������������С�����������ƽ�ⳣ����ϡ�ͺ�HX��Һ��ˮ���������c��H+��_____��������������������������С�������������Һ��ˮ���������c��H+����������_____��
��4����֪100��ʱ��ˮ�����ӻ�Ϊ1��10��12�����¶��²��ij��ҺPH=7������Һ��_____�����������������������������ԣ������¶���PH=1��H2SO4��ҺaL��PH=11��NaOH��ҺbL��ϣ������û��ҺPH=2����a��b=_____��