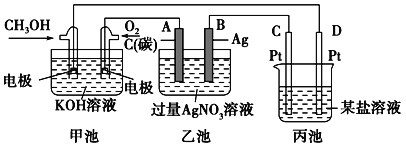
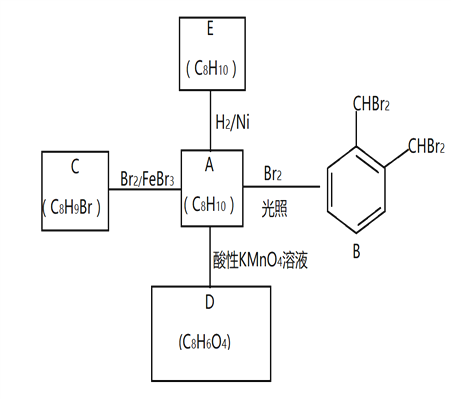
题目内容
【题目】某硫酸厂周围的空气含有较多二氧化硫,某化学兴趣小组设计了以下装置和方法测定空气(内含N2、O2、SO2、CO2等)中SO2含量。
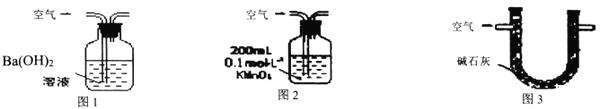
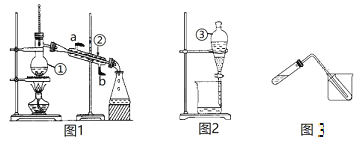
甲.用图1所示装置,通入V升空气,测定生成沉淀的质量
乙.用图2所示装置,当KMnO4溶液刚好褪色时,测定通入空气的体积V
丙.用图3所示装置,通入V升空气,测定U型管增加的质量
(1)你认为可行的操作是________。(填“甲、乙、丙”)
(2)某环保部门为了测定空气中SO2含量,做了如下实验:取标准状况下的空气VL,缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①若通入气体的速率过快,则测定的SO2的体积分数_______。(选填“偏高”、“偏低”或“不受影响”)。
②如何判断氯化钡溶液已经加过量_______。
【答案】 乙 偏低 静置,待溶液澄清后,再向上层清液中滴加氯化钡溶液,若无沉淀生成说明沉淀完全,氯化钡过量
【解析】本题考查实验方案设计与评价,(1)根据题中信息,空气中含有N2、O2、SO2、CO2,甲装置CO2和SO2都能与Ba(OH)2溶液反应生成沉淀,即CO2对SO2的测定产生干扰,故甲装置不可行;乙装置:SO2具有还原性,能使酸性高锰酸钾溶液褪色,其余气体不能使酸性高锰酸钾溶液褪色,故乙装置可行;丙装置:碱石灰能吸收CO2和SO2,CO2对SO2的测定产生干扰,故丙装置不可行;(2)①通入气体速率过快,SO2不能完全被吸收,测定的SO2的体积分数偏低;②检验BaCl2过量,操作是:静置,待溶液澄清后,再向上层清液中滴加氯化钡溶液,若无沉淀生成说明沉淀完全,氯化钡过量,或者静置,待溶液澄清后,取上层清液少许,置于试管,向试管中滴加Na2SO4溶液,如果出现白色沉淀,说明BaCl2过量。