题目内容
A、B、C、D是四种常见单质,其对应元素的核电荷数依次增大,其中B、D属于常见金属,E、F、G化合物。所有物质之间有如下的转化关系:


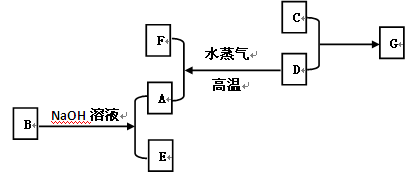
(1)写出D→A+F的化学方程式: ;
(2)写出B→A+E的离子方程式: 。
(3)将G的饱和溶液滴入沸水中可形成红褐色的透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是___________________;
(4)向含0.1 mol E的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g,则加入盐酸体积为 mL。




(1)写出D→A+F的化学方程式: ;
(2)写出B→A+E的离子方程式: 。
(3)将G的饱和溶液滴入沸水中可形成红褐色的透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是___________________;
(4)向含0.1 mol E的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g,则加入盐酸体积为 mL。
(1)3Fe +4H2O (g) Fe3O4 +4H2(2) 2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑;
(3)红褐色变浅;(4)10和(或)50
(3)红褐色变浅;(4)10和(或)50
试题分析:能与氢氧化钠溶液反应的常见金属是Al,则A是氢气,E是NaAlO2,与水蒸气反应的金属是Fe,F为Fe3O4,依核电核数依次增大且C是单质可知C是氯气,G是氯化铁。(1)Fe与水蒸气生成Fe3O4和H2。(2)反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。(3)氯化铁饱和溶液滴入沸水中可形成氢氧化铁胶体,氢氧化铁胶料带正电荷,通直流电,阳极颜色变浅。(4)AlO2-+H++H2O=Al(OH)3↓,沉淀物质的量为0.05mol,n(AlO2-)=0.1mol,所以盐酸少量或过量。盐酸少量时,形成0.05mol沉淀需要盐酸0.05mol,体积为10mL;盐酸过量时,完全沉淀AlO2-需要盐酸0.1mol,生成0.1mol沉淀,溶解0.05mol沉淀需要盐酸0.15mol,所以一共需要盐酸0.25mol,体积为50mL。
点评:熟记各类无机物的性质。

练习册系列答案
相关题目


 请回答下列问题:
请回答下列问题: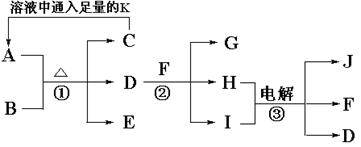

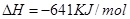


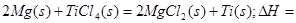 ____________
____________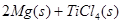

 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________