题目内容
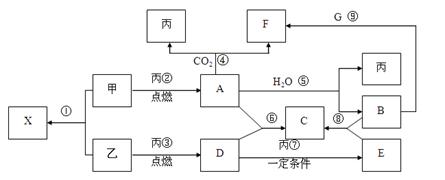
图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去)。
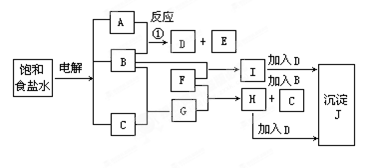
请填写下列空白:
(1)物质B是______,F是_______,J是______。
(2)反应①的离子方程式是 。

请填写下列空白:
(1)物质B是______,F是_______,J是______。
(2)反应①的离子方程式是 。
(1)Cl2,Fe,Fe(OH)3
(2)Cl2+2OH-=ClO-+Cl-+H2O
(2)Cl2+2OH-=ClO-+Cl-+H2O
【错解分析】第(1)问:①F是NaCl,J是AgCl。②F是Fe(正确),但J答成Fe(ClO)3。
第(2)问:①Cl2+2NaOH=NaCl+NaClO+H2O。
②Cl2+OH-=Cl-+ClO-+H2O。
③Cl2+2OH-=Cl-+HClO。
④Cl2+2Na++2OH-=Cl-+NaClO+H2O。
⑤Cl2+2NaOH=Cl-+ClO-+H2O。
⑥Cl2+2Na++2OH-=Cl-+ClO-+2Na++H2O
第(1)问:出现①误区,是由于对题干中“粗框表示初始反应物”理解错了,误认为F仍是饱和食盐水,影响了各步的推断,只好凭主观感觉,写J是AgCl。同时也反映出部分同学的思维能力差,在F是“NaCl”推导不下去的时候,应换一种物质,另行推导,及时调整自己的思路,以求出正确的结果。出现②误区,是由于对溶液中发生的水解反应和离子反应不清楚,未考虑到次氯酸是弱酸(比碳酸的酸性还弱),故NaClO水溶液呈碱性,而Fe3+水解,溶液呈酸性,通过水解平衡移动,可得出沉淀物为Fe(OH)3。也没有考虑到Fe3+直接与溶液中OH-结合,生成Fe(OH)3沉淀,故导致了失误。
第(2)问:出现①误区,是由于未审清题意,答非所问,误将离子方程式写成化学方程式,导致失误。出现②误区,是由于离子方程式未作配平检查所致。出现③、④误区,是由于对Cl2与强碱溶液反应的本质未掌握,误认为碱性条件下能生成次氯酸,或把NaClO误认为是弱电解质,导致失误。出现⑤、⑥误区,是由于不掌握离子方程式书写的要点和技能,导致失误。
【正解】审视框图,两个粗框表示初始反应物,第一个粗框中是饱和食盐水,经电解可得NaOH,Cl2和H2,这个反应是大家熟知的,但究竟A,B,C各是何物?还要看与之相关的反应才能判断。据B与A反应生成两种产物,而B与C只生成一种产物,可推知:B为Cl2,C为H2,A为NaOH。至此反应①的离子方程式就能写出来了。
第二个粗框中是F,F与B反应生成I,F与G反应生成H,且H与B反应又得到I,由此可推知:H,I是同种金属的氯化物,F是变价金属元素的单质。头脑中应立即出现三个熟悉的化学反应:2Fe+3Cl2
 2FeCl3(B+F→I)
2FeCl3(B+F→I)Fe+2HCl=FeCl2+H2↑ (G+F→H)
2FeCl2+Cl2=2FeCl3 (B+H→I)
据此得出F就是Fe的结论。
再看I和H,在加入D之后,均得沉淀J,可知D不可能是NaCl,只能是NaClO。NaClO溶液呈强碱性;HClO是很弱的酸,又是氧化性很强的酸;Fe2+会被氧化成Fe3+;Fe3+与OH-在溶液中不能大量共存,会产生Fe(OH)3沉淀,所以无论是FeCl3与NaClO溶液混合,还是FeCl2与NaClO溶液混合,都会得到Fe(OH)3沉淀(J)。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目