题目内容
【题目】金属跟氯气反应,不能直接制得的是
A.氯化铜B.氯化亚铁C.氯化镁D.氯化钾
【答案】B
【解析】
A. 铜和氯气点燃生成氯化铜,故不选A;
B. 铁和氯气点燃生成氯化铁,不能生成氯化亚铁,故选B;
C. 镁和氯气点燃生成氯化镁,故不选C;
D. 钾和氯气点燃生成氯化钾,故不选D。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下: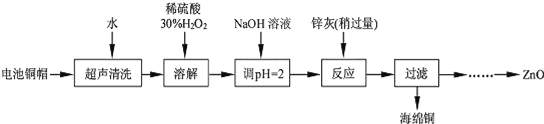
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2 反应的离子反应方程式______________________;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I﹣═2CuI(白色)↓+I2 2S2O32﹣+I2═2I﹣+S4O62﹣
①滴定选用的指示剂为______________,滴定终点观察到的现象为_______________________________;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为__,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会__(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2]=2.0×10﹣20,计算沉淀生成后溶液中c(Cu2+)=__mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2﹣。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0molL﹣1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0molL﹣1HNO3、1.0molL﹣1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
②加入适量的1.0molL﹣1NaOH调节pH,产生沉淀;③过滤;
④______________;⑤过滤、洗涤、干燥;⑥900℃煅烧。