题目内容
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程: 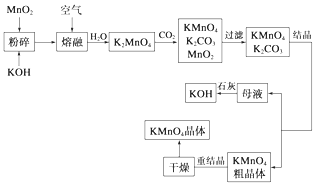
(1)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列(填序号)物质相似.
A.75%酒精
B.双氧水
C.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式: .
(3)向K2MnO4溶液中通入CO2以制备KMnO4 , 该反应中的还原剂是 .
(4)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得mol KMnO4 .
【答案】
(1)BC
(2)2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O
2K2MnO4+2H2O
(3)K2MnO4
(4)![]()
【解析】解:(1)高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒,A、酒精是通过渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故错误;B、双氧水具有强氧化性,常常利用双氧水的强氧化性进行杀菌消毒,故正确;C、次氯酸钠具有强氧化性,常常利用次氯酸钠的强氧化性进行杀菌消毒,故正确;所以答案是:BC;(2)MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4 , 根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为﹣2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O; 所以答案是:2MnO2+4KOH+O2
2K2MnO4+2H2O; 所以答案是:2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O; (3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2 , 反应只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,所以K2MnO4既是氧化剂又是还原剂;所以答案是;K2MnO4;(4)根据原子守恒知,1molMnO2可制得1molK2MnO4 , K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2 , 反应方程式为3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3 , 3mol锰酸钾生成2mol高锰酸钾,所以1mol二氧化锰生成
2K2MnO4+2H2O; (3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2 , 反应只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,所以K2MnO4既是氧化剂又是还原剂;所以答案是;K2MnO4;(4)根据原子守恒知,1molMnO2可制得1molK2MnO4 , K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2 , 反应方程式为3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3 , 3mol锰酸钾生成2mol高锰酸钾,所以1mol二氧化锰生成 ![]() mol高锰酸钾;所以答案是:
mol高锰酸钾;所以答案是: ![]() .
.

