题目内容
【题目】下列实验设计及描述不正确的是
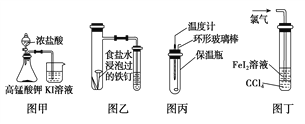
A. 图甲所示的实验,探究氧化性:KMnO4>Cl2>I2
B. 图乙所示的实验,根据小试管中液面的变化判断铁钉发生析氢腐蚀
C. 图丙所示的实验,根据温度计读数的变化用稀盐酸和NaOH溶液反应测定中和热
D. 图丁所示的实验,根据试管中液体颜色的变化比较Cl2、Fe3+、I2的氧化性强弱
【答案】B
【解析】A、酸性高锰酸钾氧化浓盐酸生成氯气,氯气氧化碘化钾生成碘,则装置②可探究氧化性:KMnO4>Cl2>I2,故A正确;B、析氢腐蚀生成氢气,而吸氧腐蚀中氧气得电子,气体减少,用食盐水浸泡应发生吸氧腐蚀,故B错误;C、中和热测定应选稀的强酸和稀的强碱之间来反应,故C正确;D、三价铁是棕黄色溶液,碘的四氯化碳呈紫色,根据颜色的先后判断Fe2+、碘离子的还原性,还原性强的,氧化产物的氧化性弱,故D正确。故选B。

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目


