题目内容
铜单质及其化合物是应用极其广泛的物质。
(1)铜是氢后金属,不能与盐酸发生置换反应,但将单质铜置于浓氢碘酸中,会有可燃性气体及白色沉淀生成,又知氧化性:Cu2+>I2,则铜与氢碘酸反应的化学方程式为____________________________________________________。
(2)已知Cu2O能溶于醋酸溶液或盐酸中,同时得到蓝色溶液和红色固体,则Cu2O与稀硫酸反应的离子方程式为____________________________________;
Cu2O与稀硝酸反应的离子方程式为_____________________________;
只用稀硫酸来确定某红色固体是 Cu2O与Cu组成的混合物的方法:称取m g该红色固体置于足量稀硫酸中,充分反应后过滤,然后___________________。
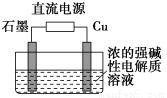
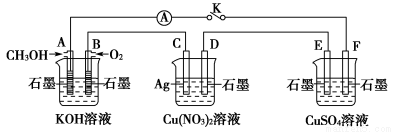
(3)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解装置如图所示,电解总反应:2Cu+H2O电解,Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
(4)现向Cu、Cu2O、CuO组成的混合物中加入1 L 0.6 mol/L HNO3恰好使混合物溶解,同时收集到2 240 mL NO(标准状况)。若将上述混合物用足量的氢气还原,所得固体的质量为________;若混合物中含有0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗硫酸的物质的量为________。
(1)2Cu+2HI=2CuI+H2↑
(2)Cu2O+2H+=Cu+H2O+Cu2+ 3Cu2O+14H++2NO3—=6Cu2++2NO↑+7H2O 洗涤、干燥剩余固体后称量,固体质量大于4m/9 g
(3)负 2Cu-2e-+2OH-=Cu2O+H2O 变大
(4)16 g 0.1 mol
【解析】 (1)由题中信息知生成的气体产物是氢气,则白色沉淀是铜的化合物 CuI,相应的反应为置换反应。
(2)Cu2O中铜为+1价,Cu2O与稀硫酸反应生成的单质铜为红色固体,生成的铜盐溶液呈蓝色。由于题目提供了样品的质量且限定试剂只用稀硫酸,故应从反应结束后剩余固体的质量角度考虑鉴定结果:若红色固体只是Cu2O,则与稀硫酸充分反应后得到固体的质量为 64m/144g=4m/9g,若最终固体的质量大于4m/9 g,则该红色固体为混合物。(3)从电解总反应知:Cu被氧化,铜电极作阳极,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O,石墨应与电源负极相连,阴极上消耗H+产生H2,故阴极周围pH变大。(4)混合物与稀硝酸反应生成0.1 mol NO,由氮元素守恒知生成Cu(NO3)2的物质的量为(1 L×0.6 mol/L-0.1 mol)÷2=0.25 mol,由此知原混合物中共含有0.25 mol铜元素;故混合物被氢气还原后可得到0.25 mol Cu,其质量为16 g。依据得失电子守恒原理得,n(Cu2O)=(0.1 mol×3-0.1 mol×2)÷2=0.05 mol,n(CuO)=0.25 mol-0.1 mol-0.05 mol×2=0.05 mol,则0.05 mol Cu2O、0.05 mol CuO与稀硫酸反应后生成0.1 mol CuSO4,则至少需要0.1 mol硫酸。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案