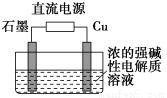
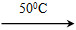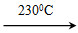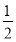题目内容
下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+2c(CO32—)
B.常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
B
【解析】 A项,在碳酸钠溶液中,物料守恒式:c(Na+)=2c(CO32—)+2c(HCO3—)+2c(H2CO3),A项错误;B项,常温下,Kw=1.0×10-14,pH=4的醋酸溶液中c(H+)=1.0×10-4mol·L-1,pH=10的氢氧化钠溶液中c(OH-)=1.0×10-4mol·L-1,由于醋酸是弱酸,其溶液中含有大量的CH3COOH,还会继续电离出H+,溶液呈酸性,B项正确;C项,由电荷守恒知c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(A-),C项错误;D项,氢氧化钡溶液中,Ba(OH)2=Ba2++2OH-,H2O??H++OH-,溶液中氢离子来自水的电离,所以pH=12的氢氧化钡溶液中水电离的c(H+)=1.0×10-12mol·L-1,而碳酸钠溶液中存在CO32—+H2O HCO3—+OH-,OH-来自水电离,水电离的OH-浓度与H+浓度相等,所以pH=12的Na2CO3溶液中水电离的c(H+)=
HCO3—+OH-,OH-来自水电离,水电离的OH-浓度与H+浓度相等,所以pH=12的Na2CO3溶液中水电离的c(H+)= 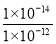 mol·L-1=1.0×10-2mol·L-1,两溶液中水电离的氢离子浓度不相等,D项错误。
mol·L-1=1.0×10-2mol·L-1,两溶液中水电离的氢离子浓度不相等,D项错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目