题目内容
【题目】 室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关说法错误的是( )

A.室温下,a点的氨水电离常数为![]()
B.将此氨水稀释,溶液的导电能力减弱
C.c点时消耗盐酸体积V(HCl)<20 mL
D.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
【答案】D
【解析】
试题分析:A、电离平衡常数K= ![]() ,正确,不选A;B、稀释氨水,虽然促进一水合氨的电离,但溶液中离子浓度减小,所以导电能力减弱,正确,不选B;C、氯化铵是强酸弱碱盐,其水溶液显酸性,要使溶液显中性,则氨水应该稍微过量,所以c点时消耗的盐酸体积小于20毫升,正确,不选C;D、温度越高,水的电离程度越大,a点的温度下偶遇d点的温度,所以a点的离子积小于b点的离子积,错误,选D。
,正确,不选A;B、稀释氨水,虽然促进一水合氨的电离,但溶液中离子浓度减小,所以导电能力减弱,正确,不选B;C、氯化铵是强酸弱碱盐,其水溶液显酸性,要使溶液显中性,则氨水应该稍微过量,所以c点时消耗的盐酸体积小于20毫升,正确,不选C;D、温度越高,水的电离程度越大,a点的温度下偶遇d点的温度,所以a点的离子积小于b点的离子积,错误,选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】下表是元素周期表的前三周期:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0[ | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三[ | G | H | I | J |
回答下列问题:
(1)J元素的元素的名称:___________。
(2)G元素与I 元素形成的化合物的电子式是___________,
A、G、E形成的化合物中含有的化学键类型为_____________________________。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,
属于两性氢氧化物的是_______________(用化合物的化学式表示)。
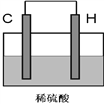
(4)将H单质与C的一种单质(导体)按如下图装置连接,其中C极为_________极(填正或负),并写出该电极反应式为:____________________。