��Ŀ����
����Ŀ����.ʯ����������δ��ϴ���������֣��������о����¹��ɹ����ڱڸ��ŵ��������������ʯ���е���̬�⻯���Ұ�1:3��Ӧ���ɵĺ�ɫ���ʱ���ȼ����ij�о�С�齫һ�����ı���ĩͶ��������Ũ�����з�����Ӧ���õ�4.8g����ɫ�����������ң����ڱ�״���µ��ܶ�Ϊ1.52g��L��1�����˺�����Һ��������ȫ���ݳ����м���������NaOH��Һ���ȳ��ְ�ɫ����������ת��Ϊ���ɫ���������ˡ�ϴ�ӡ����պ�Ĺ�������Ϊ24g����֪�����ҿ�����ˮ��
��ش�
��1������������Ԫ������Ϊ____��
��2�����������з�Ӧ�����ӷ���ʽΪ____��
��3��Ϊ�����������������д�ʩ���е���____��
A. ʯ�����ǰ���� B. ����������ϴ����
C. �����ڱ�Ϳˢ���� D. �����г��뵪��
��. ij��A������Ԫ����ɣ�����ص�ת����ϵ��ͼ�����в�����ѱ��ڿ�ͼ�ϣ�������CΪ����ɫҺ�壬�仯ѧ�����������Ԫ�صĵ������ơ�

��1������B�������ӵĵ���ʽ��____��
��2��������C�������۵���____Ԫ�ء�
��3��������C��KI��Ӧ�Ļ�ѧ����ʽΪ____��
��4�����������У�����C��Ӧ����____��
A. SO2��ˮ��Һ B. H2O C. Na D. Na2SO4
���𰸡� ������ Fe2S3+4H+=2Fe2++S��+2H2S�� AD ![]() I ICl+KI=KCl+I2 ABC
I ICl+KI=KCl+I2 ABC
����������.�����Ũ���ᷴӦ�����Һ(������ȫ���ݳ�)�м���������NaOH��Һ���ȳ��ְ�ɫ����������ת��Ϊ���ɫ����������Һ�к����������ӣ����պ�Ĺ���Ϊ������������Ϊ24g�����������ʵ���Ϊ![]() =0.15mol�����������ʵ���Ϊ0.3mol������ĩͶ��������Ũ�����з�����Ӧ���õ�4.8g����ɫ�����������ң���ɫ����ΪS�����ʵ���Ϊ
=0.15mol�����������ʵ���Ϊ0.3mol������ĩͶ��������Ũ�����з�����Ӧ���õ�4.8g����ɫ�����������ң���ɫ����ΪS�����ʵ���Ϊ![]() =0.15mol�����ڱ�״���µ��ܶ�Ϊ1.52gL-1�����ҵ���Է�������Ϊ1.52��22.4=34�������ҿ�����ˮ������ΪH2S���ڱ�����Ԫ�������ʵ����ʵ���֮��Ϊ2��1���������������̬�⻯���Ұ�1��3��Ӧ���ɵ����ʱ�������Ԫ���غ�͵��ӵ�ʧ�غ���ƶϼ�ΪFe2O3����ΪFe2S3�������ҷ����ķ�Ӧ���ɱ��ķ�ӦΪFe2O3+3H2S=Fe2S3+3H2O�����������з�����ӦΪFe2S3+4HCl=2H2S��+2FeCl2+S��
=0.15mol�����ڱ�״���µ��ܶ�Ϊ1.52gL-1�����ҵ���Է�������Ϊ1.52��22.4=34�������ҿ�����ˮ������ΪH2S���ڱ�����Ԫ�������ʵ����ʵ���֮��Ϊ2��1���������������̬�⻯���Ұ�1��3��Ӧ���ɵ����ʱ�������Ԫ���غ�͵��ӵ�ʧ�غ���ƶϼ�ΪFe2O3����ΪFe2S3�������ҷ����ķ�Ӧ���ɱ��ķ�ӦΪFe2O3+3H2S=Fe2S3+3H2O�����������з�����ӦΪFe2S3+4HCl=2H2S��+2FeCl2+S��
(1)��ΪFe2S3������������Ԫ��Ϊ�����ʴ�Ϊ��������
(2)���������з�Ӧ�����ӷ���ʽΪ��Fe2S3+4H+=2H2S��+2Fe2++S���ʴ�Ϊ��Fe2S3+4H+=2H2S��+2Fe2++S��
(3)A��ʯ�����ǰ����������ֹ��������ɣ���A��ȷ��B������������ϴ���壬��ʹ�ޱڱ䱡�������ڴ����ͣ���B����C�������ڱ�Ϳˢ���ᣬ�������л�������������У�ʹ�ʹ��Ƚ��ͣ���C����D�������г��뵪�����Ϳ��Է�ֹ�ޱ���������Fe2O3����D��ȷ����ѡAD��
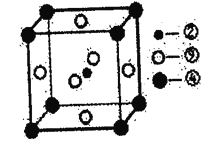
��.����ת����ϵ��1molC+KI=1mol������B+1mol����D��1mol������B���������ữ����������Һ��Ӧ���ɰ�ɫ������˵��B�к���ClԪ�أ��ƶ�C�к���ClԪ�أ��������ɵ���D�ƶ�ΪI2��BΪKCl��������������ԭ��Ӧʵ���ж�CΪICl��Ϊ����ɫҺ�壬�仯ѧ�����������Ԫ�صĵ������ƣ�1mol��A�к���Cl��I��K������Ԫ�ػ��ϼ۴�����Ϊ0�жϣ�AΪKICl2��
(1)BΪ�Ȼ��أ�������ΪCl-�������ӵĵ���ʽ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2)�Ȼ���ṹ���������ƣ�Clԭ�Ӻ�Iԭ��֮�乲��һ�Ե��ӣ�CΪICl���⻯�ϼ�Ϊ+1�ۣ���Ԫ�ػ��ϼ�Ϊ-1�ۣ��ʴ�Ϊ���⣻
(3)C��KI��Ӧ�������ǵ�Ԫ�صĹ��з�Ӧ�����ɵⵥ�ʣ���Ӧ�Ļ�ѧ����ʽΪ��KI+ICl=I2+KCl���ʴ�Ϊ��KI+ICl=I2+KCl��
(4)CΪIClΪ����ɫҺ�壬�仯ѧ�����������Ԫ�صĵ������ƣ�����ǿ�����ԣ���������ԭ�����ʺͲ�����̼ԭ���γɵ�˫�������ӳɷ�Ӧ����ˮ��������������ԭ��Ӧ��A��SO2 B���л�ԭ�Կ��Ա�ICl��������A���ϣ�B������������ˮ��Ӧ����ʽ֪���Ȼ����ˮ��Ӧ����ʽΪICl+H2O�THCl+HIO��H2O��ICl��Ӧ����B���ϣ� C����ϩ���в�����̼̼˫�������������̼̼˫�������ӳɷ�Ӧ����C���ϣ�D��Na2SO4��Һ��ICl���ܷ�����Ӧ����D�����ϣ���ѡABC��

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�����Ŀ�������������£���Ӧ��2SO2 ( g ) + O2 ( g ) ![]() 2SO3( g ) ����H =��QkJ��mol��1�����������·ֱ���������ͷ�Ӧ�ų������� ( Q>0 )���±����У�
2SO3( g ) ����H =��QkJ��mol��1�����������·ֱ���������ͷ�Ӧ�ų������� ( Q>0 )���±����У�
�� �� | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ��mol��1) |
�� | 2 | 1 | 0 | Q1 |
�� | 1 | 0.5 | 0 | Q2 |
�� | 1 | 0.5 | 1 | Q3 |
�����������ݣ�����������ȷ����
A. �����������·�Ӧ���� lmolSO3 ������� Q/2 kJ B. 2Q3 <2Q2=Q1<Q
C. Ql =2 Q2= 2Q3 = Q D. 2Q2 = 2Q3 < Q1 < Q