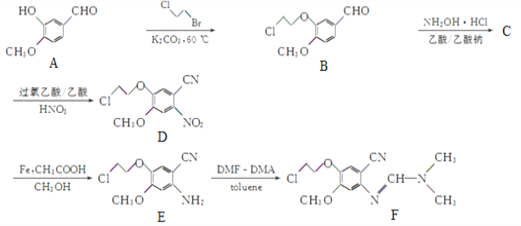
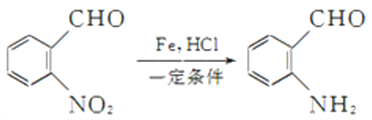
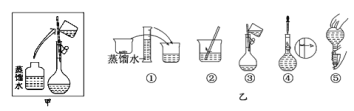
题目内容
【题目】请按要求完成下列填空:
(1)质量之比为16∶7∶6的SO2、CO、NO分子个数之比为______。
(2)1.204×1024个D2O的质量为______。
(3)9.2g NOx中含有N原子数为0.2mol,则x数值为______。
(4) 1L1mol/L的AlCl3溶液中和1.5L______mol/L的MgCl2溶液中的氯离子浓度相等。
(5)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为_______mol,其中CO2为__________mol。
(6)现有100mL 2mol/L的稀HCl溶液与足量的铁屑反应,将生成的FeCl2配成400mL溶液,此溶液中FeCl2的物质的量浓度是______________。
(7)在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1g/cm3)中,所得盐酸的密度为1.18g/cm3,该盐酸中溶质的质量分数____________,该盐酸的物质的量浓度_______________。
【答案】5∶5∶4 40g 2 1.5mol/L 1.75 0.75 0.25mol/L 36.5% 11.8mol/L
【解析】
(1)根据n= ![]() 计算物质的量之比,由N=nNA可知分子数目之比等于其物质的量之比;
计算物质的量之比,由N=nNA可知分子数目之比等于其物质的量之比;
(2)D2O的摩尔质量为20g/mol,依据n= ![]() =
= ![]() 计算解答;
计算解答;
(3)依据n= ![]() 计算解答;
计算解答;
(4)1mol/L的AlCl3溶液中氯离子浓度为3mol/L,据此计算MgCl2溶液的物质的量浓度;
(5)根据n= ![]() 计算出混合气体的物质的量;设出CO和CO2的物质的量,然后分别根据气体总物质的量、总质量列式计算;
计算出混合气体的物质的量;设出CO和CO2的物质的量,然后分别根据气体总物质的量、总质量列式计算;
(6)根据氯原子守恒确定氯化亚铁的物质的量,再根据c= ![]() 计算氯化亚铁的物质的量浓度;
计算氯化亚铁的物质的量浓度;
(7)根据w=![]() ×100%;V=
×100%;V=![]() 计算溶液的体积,再根据c=
计算溶液的体积,再根据c=![]() 计算该盐酸的浓度。
计算该盐酸的浓度。
(1)SO2、CO、NO的质量比为16∶7∶6,其物质的量之比为 ![]() ∶
∶![]() ∶
∶![]() =5∶5∶4,所以其分子数之比等于物质的量之比为5∶5∶4,故答案为:5∶5∶4;
=5∶5∶4,所以其分子数之比等于物质的量之比为5∶5∶4,故答案为:5∶5∶4;
(2)1.204×1024个D2O的质量为![]() ×20g/mol=40g;故答案为:40g;
×20g/mol=40g;故答案为:40g;
(3)9.2g氮的氧化物NOx中含有N原子数为 ![]() ×1=0.2mol,解得x=2,故答案为:2;
×1=0.2mol,解得x=2,故答案为:2;
(4)1mol/L的AlCl3溶液中氯离子浓度为3mol/L,则氯离子浓度为3mol/L时,MgCl2溶液的物质的量浓度=![]() =1.5mol/L,故答案为:1.5mol/L;
=1.5mol/L,故答案为:1.5mol/L;
(5)标准状况下39.2L CO和CO2的混合气体的物质的量为:![]() =1.75mol,设混合气体中CO和CO2的物质的量分别为x、y,则
=1.75mol,设混合气体中CO和CO2的物质的量分别为x、y,则![]() ,解得:
,解得:![]() ,即混合气体中CO为1mol,二氧化碳的物质的量为0.75mol,故答案为:1.75;0.75;
,即混合气体中CO为1mol,二氧化碳的物质的量为0.75mol,故答案为:1.75;0.75;
(6)根据氯原子守恒得n(FeCl![]() =0.1mol,c(FeCl2)=
=0.1mol,c(FeCl2)= ![]() =0.25mol/L,故答案为:0.25mol/L;
=0.25mol/L,故答案为:0.25mol/L;
(7)224L氯化氢气体物质的量为:![]() =10mol,故HCl的质量=10mL×36.5g/mol =365g,水的质量为635mL×1g/mL=635g,该溶液质量分数为
=10mol,故HCl的质量=10mL×36.5g/mol =365g,水的质量为635mL×1g/mL=635g,该溶液质量分数为![]() ×100%=36.5%,该盐酸的体积为:
×100%=36.5%,该盐酸的体积为:![]() =
=![]() L,该盐酸的物质的量浓度为
L,该盐酸的物质的量浓度为![]() =11.8mol/L,故答案为:36.5%;11.8mol/L。
=11.8mol/L,故答案为:36.5%;11.8mol/L。

 目标测试系列答案
目标测试系列答案